余金权团队Science:互变异构配体+氧气实现羧基导向的C-H键羟基化
苯酚类化合物是天然产物、药物分子的重要结构单元,如何高效地合成苯酚类化合物颇受化学家们的关注。尽管醇和烯烃的有氧氧化、有机金属络合物与PhIO和过氧化物催化的C-H键羟基化得到了广泛的研究,但利用O2实现过渡金属催化的C-H 键羟基化却寥寥无几(图1A)。迄今为止,已有研究表明三脚架配体(tripod ligand)支撑的Pt(II)-烷基络合物能与O2反应生成Pt-OOH物种(自由基链机理),后者可能会形成C-O键。但是,Mirica等人报道了一种有机金属模型,其中三脚架配体支撑的Pd(II)-烷基物种会活化O2(图1B),电子顺磁共振(EPR)和质谱分析证实了Pd(II)-烷基络合物的双电子氧化。尽管如此,要想将其与C-H键活化相结合仍颇具挑战。
在过去的几十年里,美国斯克利普斯研究所(The Scripps Research Institute,TSRI)的余金权教授(点击查看介绍)课题组开发了几类可以加速Pd催化C-H键活化的配体,但这些配体却无法促进氧化-羟基化。在此基础上,他们尝试设计一种双功能互变异构的配体骨架(即在吡啶酮和吡啶配位模式之间切换),这样就有可能利用一种配体基元(吡啶酮)来促进C-H键活化,另一种(吡啶)促进O2活化(图1B)。近日,他们在Science 发表论文,报道了一种带有双齿吡啶-吡啶酮配体的Pd(II)催化剂,利用O2实现了芳香族和杂芳香族羧酸的C-H键羟基化(图1C)。
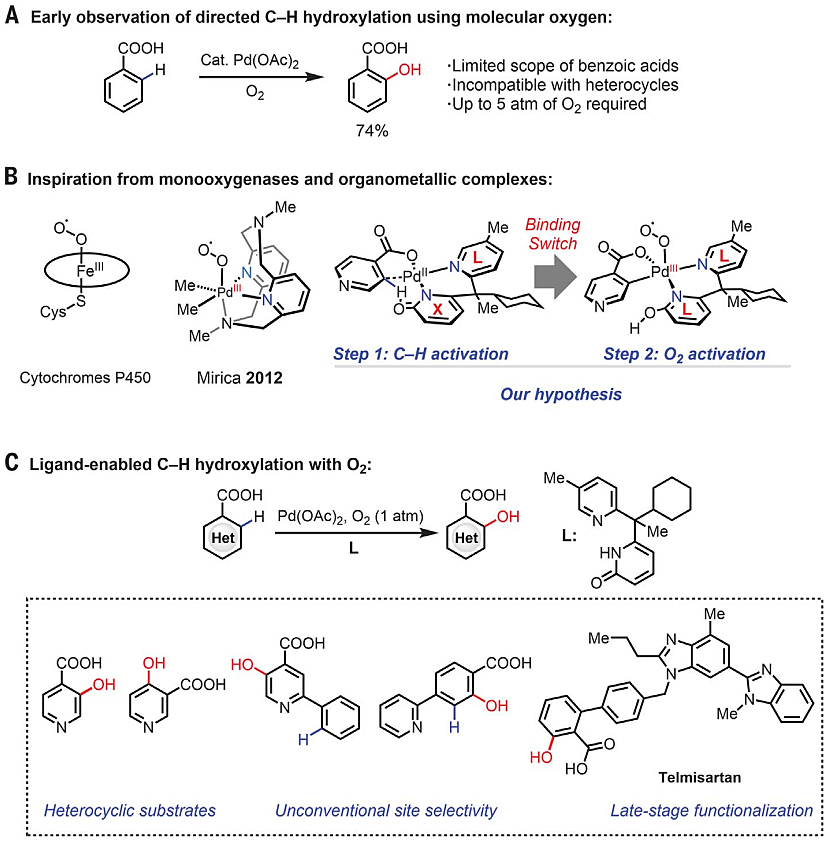
图1. 利用分子氧的C-H键羟基化。图片来源:Science
首先,作者选择异烟酸1为底物,考察了各种吡啶酮配体的配体效应。不走运的是,许多配体(L1-L19)都没有观察到所需产物。作者推断一个有效的配体必须具有双重功能:对抗杂环配位的抑制作用来加速C-H键活化,同时在O2的作用下促进Pd(II)氧化为Pd(IV)。因此,作者合成了多种可与Pd(II)形成五元金属环的吡啶-吡啶酮双齿配体(L20-L25),并在标准条件下进行测试,但未观察到C-H键羟基化产物的生成。为此,作者进行了密度泛函理论(DFT)计算,发现在反应温度下六元金属环的L,X-配位模式要比五元金属环更易获得(图2A)。于是,作者制备了能形成六元金属环的双齿吡啶-吡啶酮配体(L26-L45),其中带有环己基的配体L42能以72%的收率得到所需的邻羟基化产物(图3)。值得一提的是,当使用18O2(97%纯度)进行反应时,目标产物的18O掺入率为95%,进一步证实了O2直接参与羟基化反应。
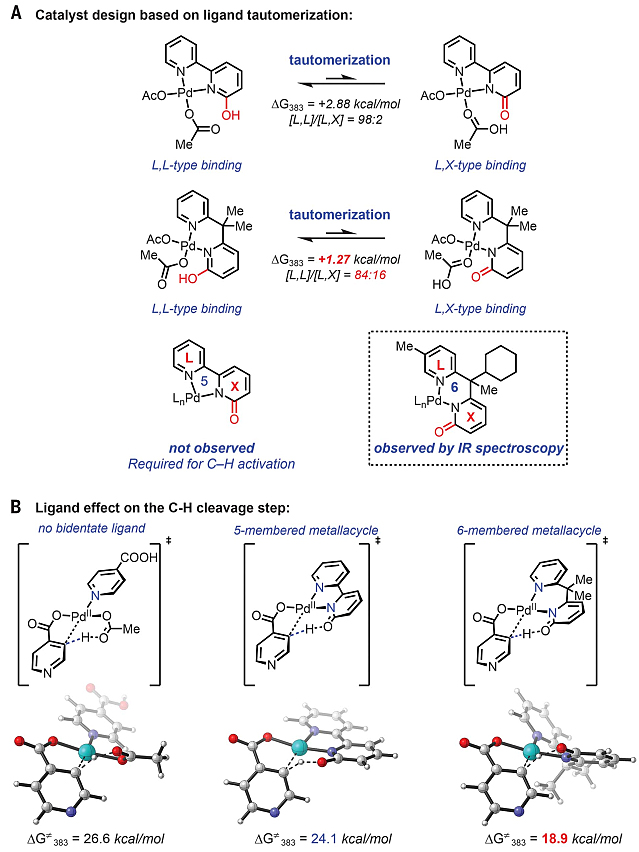
图2. 配体设计及计算分析。图片来源:Science
为了证实配体的互变异构作用,作者将配体(L20和L42)滴定到Pd(OAc)2的DME溶液中,并通过红外光谱来监测它们的配位模式。其中L42在1640 cm-1处的峰对应于吡啶酮键合模式,而L20则没有相应的羰基信号。此外,向配体L20中加入AcOH-d4也没有观察到氘掺入,这表明即使存在少量的吡啶酮键合模式,但这种配体-Pd络合物在C-H键活化中也没有反应活性。如图2B所示,在反应温度下六元配体金属环的自由能垒为18.9 kcal/mol,而五元配体金属环的自由能垒为24.1 kcal/mol,底物作为配体(乙酸盐作为 CMD 碱)时的自由能垒则为26.6 kcal/mol。
在最优条件下,作者考察了邻位羟基化反应的底物范围(图3)。对于异烟酸底物而言,无论是吸电子(1b)、给电子(1c、1d)还是卤素(1e、1f)取代都可以兼容该反应,并选择性地在位阻较小的位置进行羟基化。类似地,药物分子中常见的结构单元——杂环联芳基底物(2g和2h)也能以较高的收率实现羟基化。对于烟酸底物而言,各种2-取代烟酸都能以较高的收率提供4-羟基化产物(2j-2o),而烟酸(2i)和6-取代烟酸(2p-2r)进行反应时则得到了4-羟基烟酸(主要)和2-羟基烟酸(次要)的混合物。值得一提的是,吡啶甲酸也能实现这一转化,以较好的收率(54-70%)得到3-羟基吡啶甲酸(2s-2u)。接着,作者考察了其它杂芳族羧酸,发现喹啉(2v-2w)、四氢喹啉(2x)、喹喔啉(2y)、吲哚(2z)、苯并噻吩(2aa)、苯并噻唑(2ab)、苯并呋喃(2ac)、苯并二噁烷(2ad)、吗啉(2ae)、吡咯(2af)、咔唑(2ag)、二苯并呋喃(2ah)、二苯并噻吩(2ai)以及联芳基杂环羧酸(2aj)均能成功地实现邻位羟基化,以中等至较好的收率提供所需产物。如图3C所示,羟基化产物2a还能在PtO2为催化剂、20 atm H2下进一步氢化为取代的哌啶3;也可以与对甲基苯硼酸发生脱羧偶联反应,以65%的收率得到联芳基产物4。
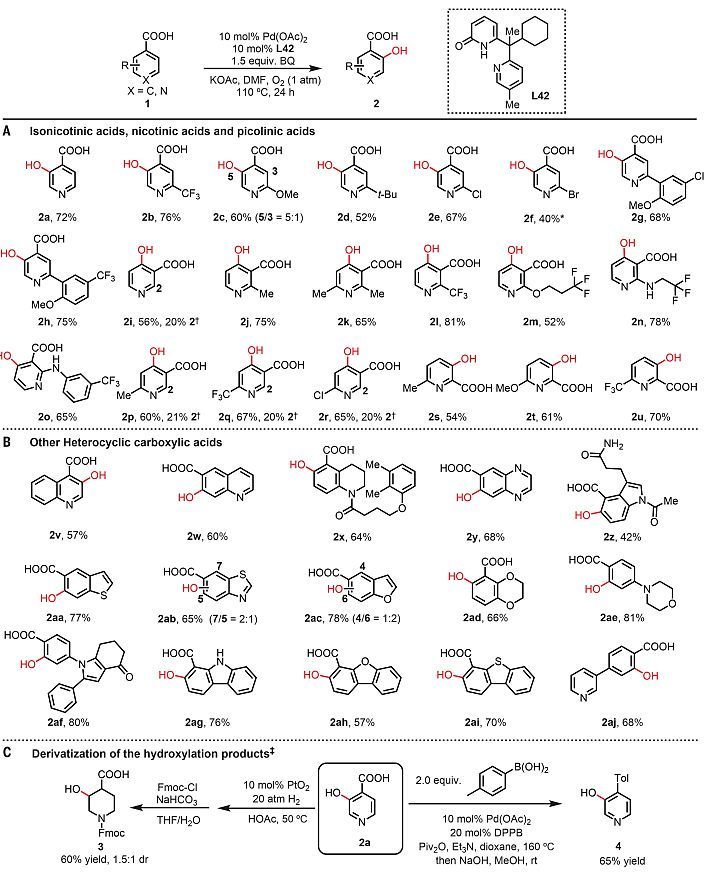
图3. 双齿吡啶酮配体促使的C-H键羟基化和产物的衍生化。图片来源:Science
在此基础上,作者考察了底物中多个导向基存在时的位点选择性(图4)。由于2-吡啶基是C(sp2)-H键活化的最强导向基团之一,因此作者考察了联芳基底物的反应效果。出乎意料的是,该反应中的弱配位羧基完全抑制了2-吡啶基的导向效应。例如,2-芳基异烟酸和6-芳基吡啶甲酸都能以中等至较好的收率(50%-79%)得到羧基导向的羟基化产物(2ak-2aq)。当羧基不在2-吡啶基上时,也得到了羧基导向的羟基化产物(2ar和2as)。值得一提的是,在AcOH-d4的存在下,氘掺入到羧基的邻位而不是吡啶基,这表明这种新配体主要有利于羧基导向的C-H键钯化。另外,当使用TBHP为氧化剂的无配体条件时,底物1ar进行吡啶导向的羟基化,以56%的收率得到产物 5。最后,作者考察了许多商业药物(如抗高血压药物替米沙坦、丙磺舒、苯妥罗胺、甲氯芬那酸、瑞格列奈、克洛尼辛、他米巴罗汀和阿塔卢伦),均能以中等至较好的收率(56-85%)得到羧基的邻羟基化产物(2aw-2bd),而这些底物在无配体条件下是不反应的。
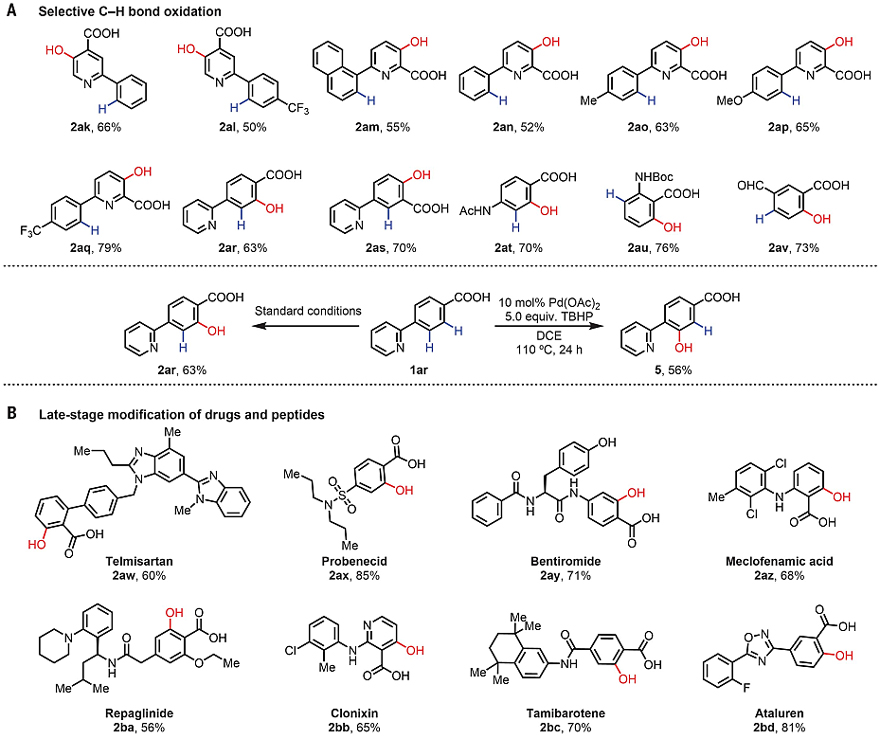
图4. 选择性C-H羟基化及后期修饰。图片来源:Science
总结
余金权教授团队报道了一种带有双齿吡啶/吡啶酮配体的钯配合物,该配合物可在氧气为氧化剂的条件下,实现羧酸的邻位C-H键羟基化反应。该方法不仅可用于药物分子的后期位点选择性C-H键羟基化,而且在药物研发中具有重要的应用价值。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A tautomeric ligand enables directed C-H hydroxylation with molecular oxygen
Zhen Li, Zhen Wang, Nikita Chekshin, Shaoqun Qian, Jennifer X. Qiao, Peter T. Cheng, Kap-Sun Yeung, William R. Ewing, Jin-Quan Yu
Science, 2021, 372, 1452-1457, DOI: 10.1126/science.abg2362
导师介绍
余金权
https://www.x-mol.com/university/faculty/694
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号