具有开壳双自由基特征的稠环芳烃
稠环芳烃,可被看成片段化的石墨烯(图1),相对于石墨烯具有半金属性、零带隙的特点,稠环芳烃可调控的带隙使其在光学、电学等方面有着极具潜力的应用。人们对于稠环芳烃的研究可以追溯到20世纪早期,Scholl和Clar发展了多种合成方法并得到了大量的稠环芳烃产物。随后在该世纪50年代到70年代,人们对于环烯芳香性的讨论促进了对稠环芳烃的进一步研究,但仍受限于合成方法以及检测手段。这种情况在20世纪末有了明显改善,归功于现代合成及分析技术的飞速发展,人们可以合成更大尺寸的稠环芳烃并对其结构性质做出详细的分析研究。十几年前单层石墨烯的发现,更是使得稠环芳烃受到了越来越多的关注。

图1. 单层石墨烯。图片来源于网络
到目前为止,绝大多数的稠环芳烃在基态时都展现出闭壳的电子构型。然而在近二十年间,研究者们在合成各种稠环芳烃的过程中,发现一些目标分子具有非常高的反应活性且在室温下核磁氢谱无信号峰出现。究其根本原因,现在可以归结为其本征的双自由基(开壳)性质。通过后续的研究表明,具有开壳结构的稠环芳烃表现出窄的单线态三线态能级差(ΔES‑T)、双极性特征、单光子吸收(S0-S2)以及双光子吸收(S0-S1)等等,这些性质不仅使得此类分子在有机自旋电子学、有机磁体、单线态裂分以及非线性光学等领域拥有着极具潜力的应用前景,同时也给研究者们提供了精确表征它们的手段。例如,小的ΔES‑T可以方便调控分子的磁性以及自旋多重度,从而可以通过变温核磁(NMR)、电子顺磁共振(EPR)以及超导量子干涉仪(SQUID)等表征手段进行测试。同时,理论计算也为具有开壳层结构的稠环芳烃提供了进一步的证明。
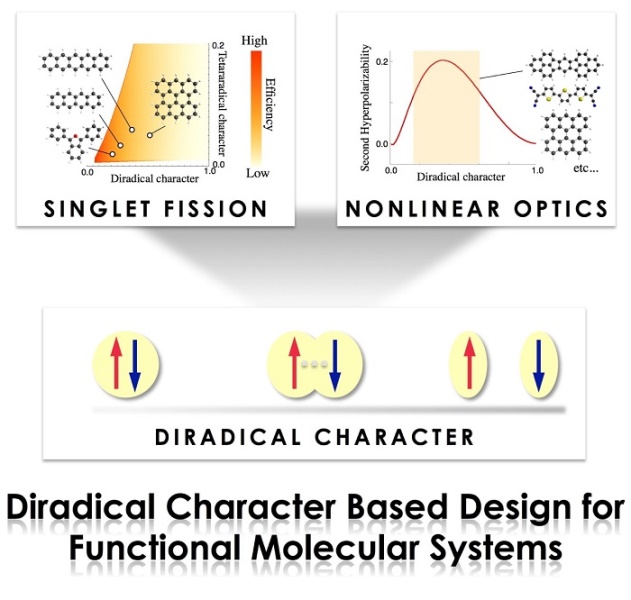
图2. 具有双自由基特征分子的应用。图片来源:Chem. Rec., 2017, 17, 27–62
1907年,Tschitschibabin首次报道了一种具有醌式结构的碳氢化合物(图3,Ber. Dtsch. Chem. Ges., 1907, 40, 1810-1819),该化合物具有非常高的反应活性,对氧气十分敏感。而如此高的反应活性可归因于它独特的开壳(双自由基)结构。通过对此化合物进行简单的共振结构分析可以发现,它的双自由基型共振结构相比于其醌式结构,额外获得了两个Clar芳香六隅体,也就是说该结构获得了额外的芳香稳定能,从而对共振杂化体产生较大的贡献,同时这种贡献度可用自由基指数y进行量化。此Clar芳香六隅体规则也可广泛用于对稠环芳烃是否具有双自由基性质进行大致的预测。在此之后,一系列的具有醌式结构的稠环芳烃被合成出来,并表现出相似的开壳的自由基性质。尤其在过去20年间,由于合成及检测技术的突飞猛进,大量的且相对稳定的具有自由基性质的稠环芳烃被合成出来,这使得人们可以系统性地全面地去研究此类分子的光学、电学以及磁学性质。
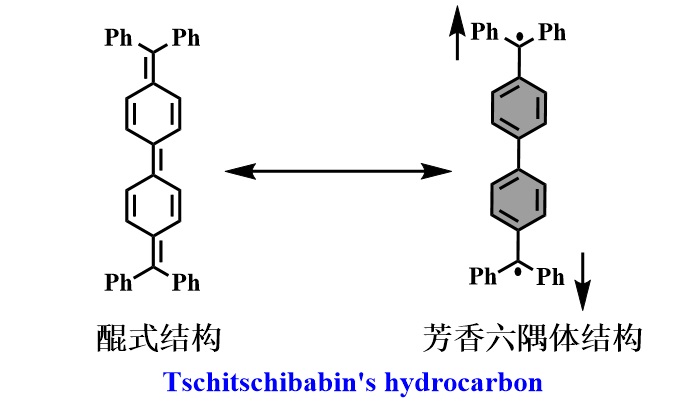
图3. Tschitschibabin稠环芳烃的共振结构式。
接下来,本篇文章将从以下三个体系来讨论近些年在溶液中合成的具有双自由基特征的稠环芳烃:(1)基于非那烯(Phenalenyls)的双自由基体系;(2)Z型并苯体系;(3)具有锯齿状边缘结构的体系。其他具有开壳双自由基特征的体系(如基于五元环自由基的茚-芴体系以及七元环自由基体系)将在后续的文章中进行讨论。
1. 非那烯(Phenalenyls)
由于最早发现的双自由基分子(Tschitschibabin’s hydrocarbon)就是基于芳香苯环与其醌式结构的共振,因此研究者们就设想如果将类似的醌式结构嵌入更大的稠环体系,是否也能获得相似的双自由基性质。Nakasuji和Kubo等人在本世纪初发展了一系列基于双非那烯的稠环芳烃体系(图4b,Angew. Chem. Int. Ed., 2005, 44, 6564–6568; 图4c,J. Am. Chem. Soc., 2010, 132, 14421–14428; 图4d,Chem. Commun., 2012, 48, 5629–5631),并通过详细的表征确认了它们的双自由基性质。如图4所示化合物1包含了一个对醌二甲烷的结构,同时化合物2、3分别嵌入了一个更大的醌式结构单元(萘醌甲烷、蒽醌甲烷)。在这三个化合物中,它们的室温核磁氢谱都表现出较宽的信号峰甚至消失,而随着温度降低,信号峰逐渐出现然后慢慢变尖,这种现象也间接说明了这些分子在基态表现出单线态双自由基性质。同时这三个双自由基分子展现出独特的物理化学性质,如窄的HOMO-LUMO能级差,双极性电荷传输行为以及强的双光子吸收。值得注意的是,随着嵌入更大的醌式结构单元,它们的自由基指数也随之增加(化合物1-3:0.3、0.5、0.68)。
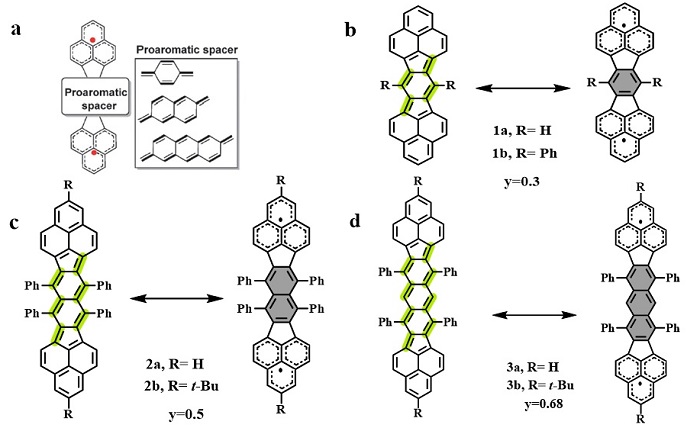
图4. Nakasuji和Kubo等人报道的基于双非那烯结构的双自由基分子。
2. Z型并苯(Zethrenes)
Z型并苯可被看作是两个非那烯单元头对头的拼接,分子形状类似Z型结构,因而被称作Z-型并苯。Z型并苯在1955年首次被Clar报道出来(图5a),实验证明该分子表现为闭壳的醌式结构,且具有一定的稳定性。这与Clar六隅体规则分析结果相吻合:两种共振结构的Z型并苯具有相同的芳香六隅体,因此没有额外的芳香稳定能去补偿因形成自由基而断裂的C-C键。同时由此规则预测随着Z型并苯共轭体系的延伸,其衍生物会逐渐表现出越来越明显的开壳双自由基特征。
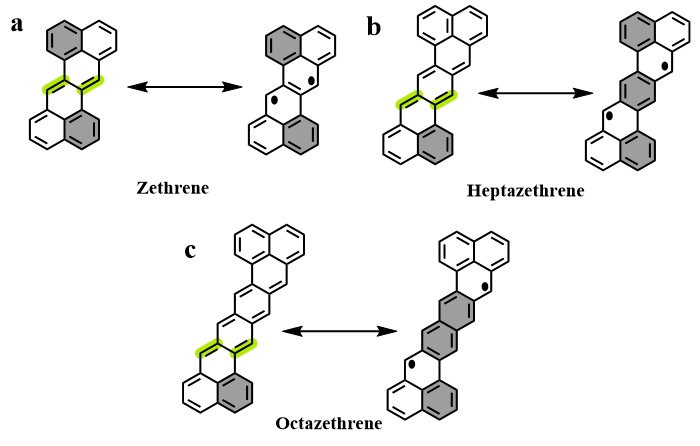
图5. Clar等人报道的Z型并苯(a),Z型并七苯(b),Z型并八苯(c)。
但直到2011年,新加坡国立大学的吴继善教授领导的团队才首次报道了具有开壳单线态双自由基特征的Z型并七苯衍生物(图6,J. Am. Chem. Soc., 2011, 133, 11896–11899)。同样的,该化合物的室温核磁氢谱几乎没有信号峰被观察到,但随着温度的降低,信号峰逐渐出现,表明了其基态具有单线态双自由基的特征。
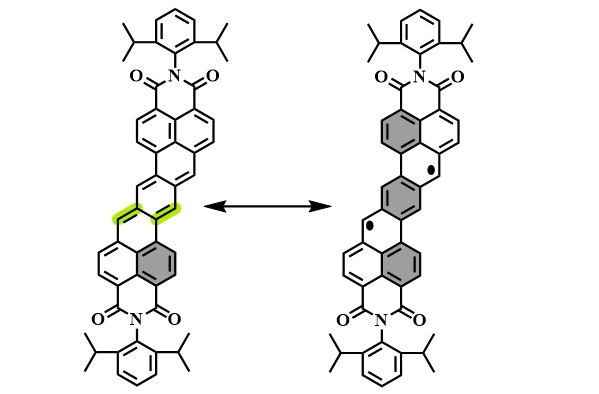
图6. 吴继善等人报道的首例具有开壳双自由基特征的Z型并七苯衍生物。
随后该课题组持续深耕该领域,通过对Z型并苯的共轭体系进行横向或/和纵向的延伸,先后合成了一系列的具有开壳双自由基结构特征的Z型并苯衍生物(图7),如Z型并八苯(J. Am. Chem. Soc., 2012, 134, 14913−14922)、Z型并九苯(J. Am. Chem. Soc., 2016, 138, 10323−10330)、苯并Z型并七苯(J. Am. Chem. Soc., 2013, 135, 18229−18236)、Super-heptazethrene(Angew. Chem. Int. Ed., 2016, 55, 8615–8619)以及Super-octazethrene(J. Am. Chem. Soc., 2018, 140, 14054−14058)。可以看出随着Z型并苯共轭体系的扩大,其自由基指数(y)也随着增加。因此要想成功制备并分离出目标分子,该课题组在自由基活性位点引入了大位阻基团(如TIPS基团)或吸电子基团(2,6-二氯苯基)去稳定该分子。而这些具有一定稳定性的双自由基分子在有机电子学,非线性光学以及有机自旋磁体等领域有望获得应用。如近期天津大学孙哲课题组报道了一个具有开壳双自由基特征的苯并Z型并七苯分子(Angew. Chem. Int. Ed., 2021, DOI: 10.1002/anie.202105872),并应用于构建对空气稳定的有机场效应晶体管,其迁移率达到了0.15 cm2 V-1 S-1。
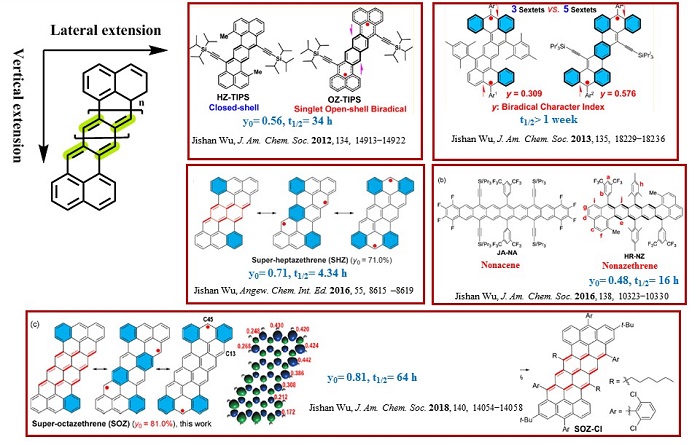
图7. 吴继善等人报道的具有开壳双自由基特征的Z型并苯衍生物。
3. 锯齿型稠环芳烃
并苯是一类由苯环单元线性地连接而成,可被看作最简单的锯齿型石墨烯纳米带。从它的闭壳结构可以看出,只有一个芳香六隅体存在,整个分子更多地表现出双烯/多烯的特征,因此具有非常高的反应活性。从并六苯开始往后的并苯分子,极其的不稳定,同时理论计算表明其具有开壳双自由基的特征,这也可以从Clar六隅体规则来理解(图8)。
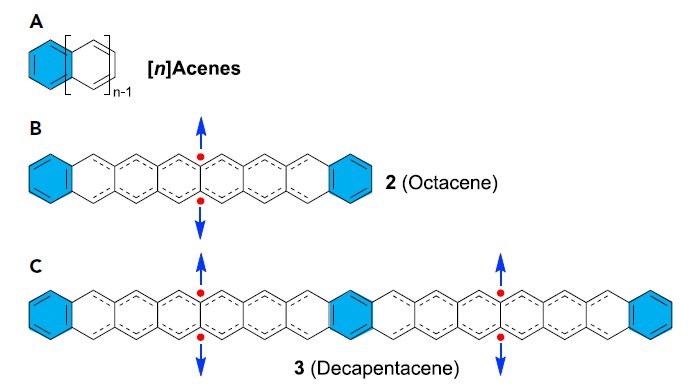
图8. A: 并苯的结构;B: 并八苯的双自由基结构;C: 并15苯的四自由基结构。图片来源: Chem, 2021, 7, 358–386
相比较于并苯在溶液中较大的合成与分离难度,对(n,m) peri-acene的制备与性能研究获得了研究者们的青睐。类似于Z型并苯,对(n,m) peri-acene的合成与研究也主要存在两个方向,分别为横向延伸(n)和纵向延伸(m)(图9a)。最小的peri-acene为Scholl在1910年报道的苝(图9b),从Clar 六隅体规则可以判断该分子无开壳双自由基特征,而在1948年由Clar报道的bisanthene中,其双自由基共振结构获得了两个额外的芳香六隅体,但理论计算得到的双自由基指数y仅为0.07。这两个分子目前也被广泛用于有机光电材料当中。因此,研究者们尝试通过横向及纵向扩大该类分子的共轭体系以获得更高的自由基指数并取得了一定的成果。
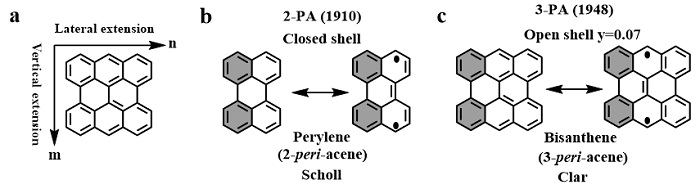
图9. a: 横向,纵向延伸(n,m) peri-acene; b: 2-PA的共振结构; c. 3-PA的共振结构。
冯新亮团队在2015年报道了一种名为bistetracene的稠环芳烃(Angew. Chem. Int. Ed., 2015, 54, 12442–12446),其中两个并四苯通过两个单键连接在一起,虽然它并不是严格意义上的(n,m) peri-acene。从该分子的共振结构可以知道(图10a),其双自由基形式相对于闭壳结构,额外获得了三个芳香六隅体,因此该分子表现出极高的反应活性,在空气存在的条件下很快就会被氧化成二酮(图10c),这也和其较高的自由基指数相符(y= 0.615)。变温核磁氢谱(图10b)也证明了bistetracene基态的开壳双自由基特征。
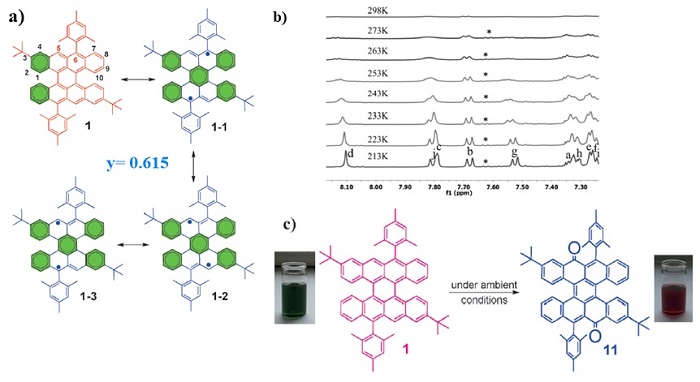
图10. a: bistetracene的共振结构; b: bistetracene的变温核磁氢谱; c. bistetracene的氧化。图片来源:Angew. Chem. Int. Ed., 2015, 54, 12442–12446
随后在2018年,冯新亮团队(图11a,J. Am. Chem. Soc., 2018, 140, 6240−6244)和吴继善团队(图11b,Angew. Chem. Int. Ed., 2018, 57, 9697–9701)几乎采用了相同的策略相继报道了横向延伸的bisanthene分子:peri-tetracene (4-peri-acene)。不同的是,吴继善团队采用了吸电子基团(2, 6-二氯苯基)来稳定活性自由基位点,因此可以看出图11b目标分子具有相对较高的稳定性,且成功地长出了单晶,准确无误地确定了4-peri-acene的结构。
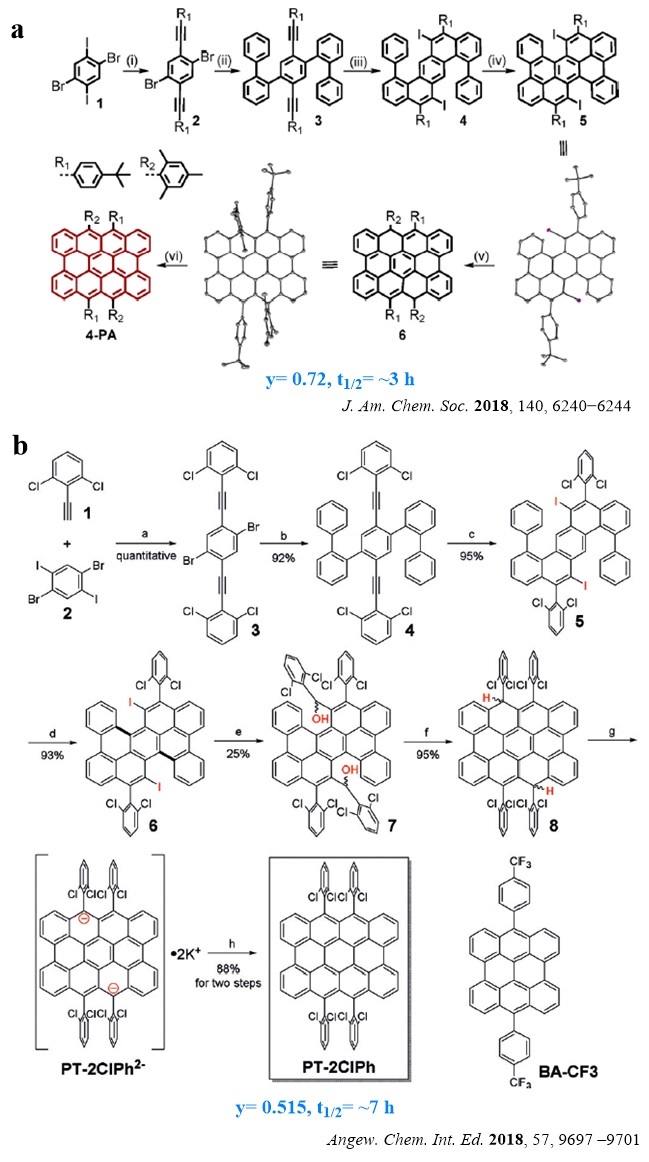
图11. a: 冯新亮团队报道的4-peri-acene; b: 吴继善团队报道的4-peri-acene。
近期,冯新亮团队再次在peri-acene的横向延伸方向上取得了进展(Angew. Chem. Int. Ed., 2021, 60, 13853-13858),该团队首次合成了7-peri-acene(7-PA)并在惰性气体保护下原位表征了该分子的结构特征。理论计算表明,该分子的双自由基指数为1,四自由基指数为0.22(图12),这就意味着7-PA具有完全分离的未成对电子,因此表现出极高的反应活性。
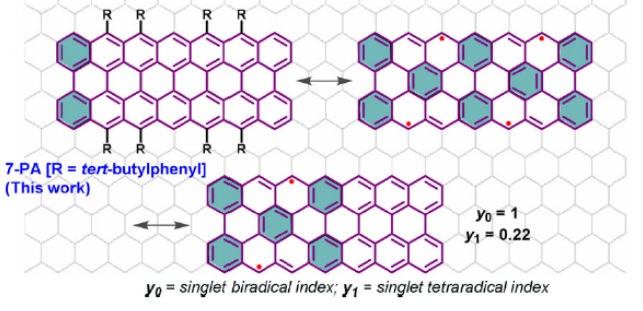
图12. 冯新亮团队报道的7-peri-acene。图片来源: Angew. Chem. Int. Ed., 2021, 60, 13853-13858
首例对bisanthene进行纵向延伸的是Kubo团队在2010年报道的teranthene(J. Am. Chem. Soc., 2010, 132, 11021−11023)。从其共振结构可以看出(图13),相比较于闭壳结构,其双自由基结构获得了三个额外的芳香六隅体。实验和理论计算(y=0.42)都表明teranthene在基态时具有开壳双自由基特征。该团队通过在自由基活性位点引入大位阻基团(均三甲苯基)来稳定分子结构,因此其半衰期达到了三天。
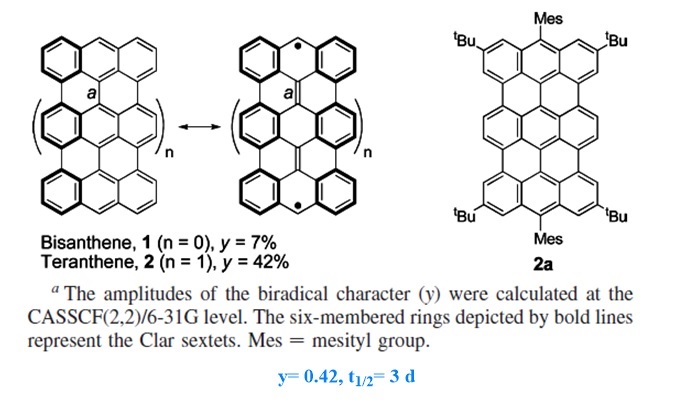
图13. Kubo团队报道的teranthene。图片来源: J. Am. Chem. Soc., 2010, 132, 11021−11023
紧接着该团队在teranthene的基础上继续进行纵向延伸,并在2013年报道成功制备并分离了quarteranthene(图14,J. Am. Chem. Soc., 2013, 135, 1430−1437)。通过对比发现,随着共轭体系的纵向扩大,分子的自由基指数也相应的增长,结合半衰期的数据,分子的稳定性也在不断地下降。
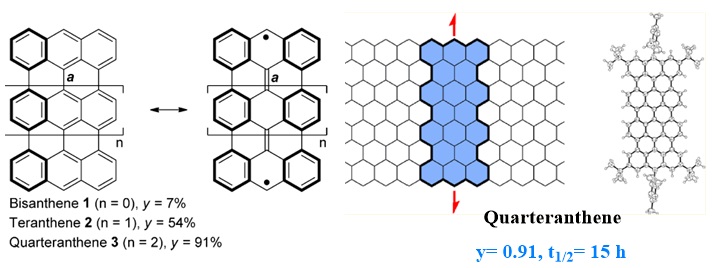
图14. Kubo团队报道的quarteranthene及其共振结构。图片来源: J. Am. Chem. Soc., 2013, 135, 1430−1437
最近,新加坡国立大学的池春彦团队对bisanthene共轭体系同时进行横向和纵向的延伸,成功制备并分离出了迄今为止最大的peri-acene分子:(4,3) peri-acene(图15d,Angew. Chem. Int. Ed., 2021, 60, 4464-4469)。与同类型的分子相比较,(4,3) peri-acene具有非常大的自由基指数(y= 0.948),但却具有一定程度的稳定性且获得了单晶数据,这可能归功于该分子的大多数活性位点被大位阻芳基(均三甲基苯基)和吸电子芳基(2,4,6-三氯苯基)所占据。同时由于更大的自由基指数和局部芳香性,使得该分子具有与其较小尺寸的类似物(teranthene和4-peri-acene)不同的光电性质,如更小的ΔES‑T、明显的顺磁性质。
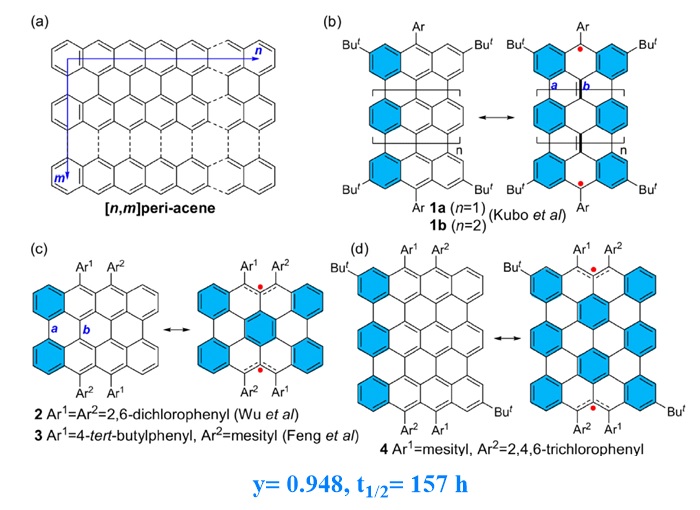
图15. 池春彦团队报道的(4,3) peri-acene(d)及其类似物(b,c)。图片来源: Angew. Chem. Int. Ed., 2021, 60, 4464-4469
(本文由Finisher供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号