倍半萜内酯之跬步:furanoheliangolide全合成及化学生物学
截至目前,人类已经合成的分子在107数量级,而符合类药五原则的分子总数为1060(相关阅读:"化学空间"究竟包括多少有机分子?),已分离并鉴定的天然产物则只有105数量级(J. Chem. Inf. Model., 2018, 58, 1518-1532)。虽然数量有限,但有着数亿年进化史的天然产物在药物研发中拥有着举足轻重的地位。倍半萜内酯结构复杂、活性多样、分布广泛,仅菊科植物就有超过3000个被分离鉴定。该家族也诞生了许多明星分子,如青蒿素 (Artemisine)、小白菊内酯 (Parthenolide)、堆心菊内酯 (Helenalin)等。Furanoheliangolide是其中一类高氧化态、骨架官能团多样并含有多个 (连续) 手性中心的倍半萜内酯。迄今已有200多个该家族天然产物被分离报道,然而其中仅有两个被合成。与此同时,该家族天然产物往往含有多个Michael受体,这预示着该类分子很可能会参与到与蛋白质半胱氨酸残基的共价结合中。探索该家族天然产物的合成和分子机制充满挑战。近日,瑞士日内瓦大学Nicolas Winssinger教授课题组完成了16个倍半萜内酯的不对称全合成及相关靶点发现和作用机制阐明工作,相关成果发表在ACS Central Science 上。
生源上,倍半萜内酯都是从法尼基焦磷酸 (Farnesyl pyrophosphate) 经环化/氧化等步骤而来(图1)。合成上,α-亚甲基-γ-丁内酯对多种反应条件如亲核加成、还原、环加成、自由基等敏感,因此常规的倍半萜内酯合成都是骨架和丁内酯分别构建。而在这项工作中,该团队创新地运用Barbier类型烯丙基化一步构建吉玛烷型倍半萜内酯(18,图一),并利用金催化环化反应构建呋喃类型五元环,基于build/couple/pair策略快速合成了包括高雅支内酯(goyazensolide,1)、巴西菊素C(eremantholide C,14)、圆叶肿柄菊素C(tagitinin C,17)在内的16个倍半萜内酯天然产物,其中15个为furanoheliangolide类型,所有天然产物均为首次合成报道,总步数在10-14步。
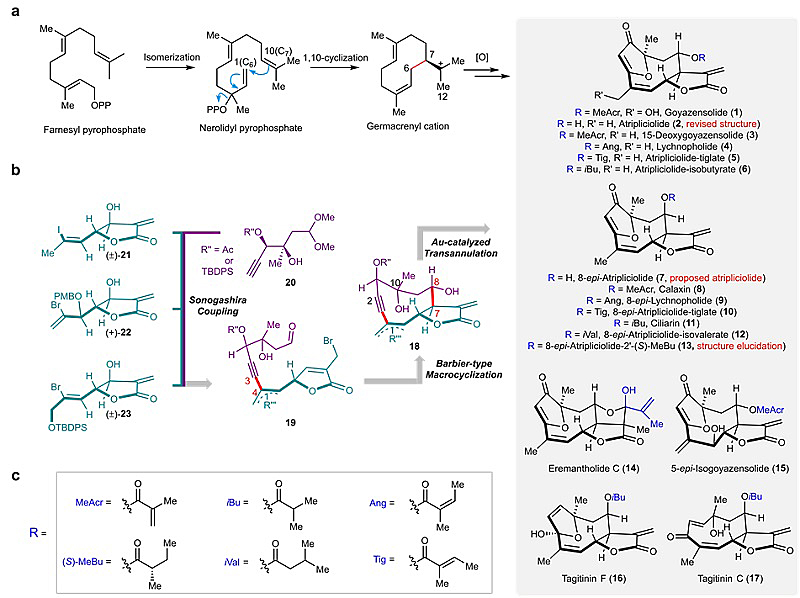
图1. 倍半萜内酯1-6、8-17的生源及逆合成分析。
值得一提的是,该全合成工作顺利地修正了天然产物atripliciolide的结构,通过核磁分析、单晶衍射等手段证明其C8位羟基构型为α(2)而非β(8)。这意味着自1978年该结构报道以来,所有以atripliciolide为骨架命名的天然产物的名字都需要进行修改。该路线也最终敲定了天然产物13的结构,通过分别合成两种不同侧链指出侧链手性中心为S-构型,为40多年前的分离文献画上了句号。
此外,Barbier类型烯丙基化也被拓展到分子间反应,并顺利地应用到天然产物合成中。如图2所示,以串联的烯丙基化/酯交换为关键步骤,paraconic acid和两个开环愈创木内脂类倍半萜被分别以2步和6步快速合成。
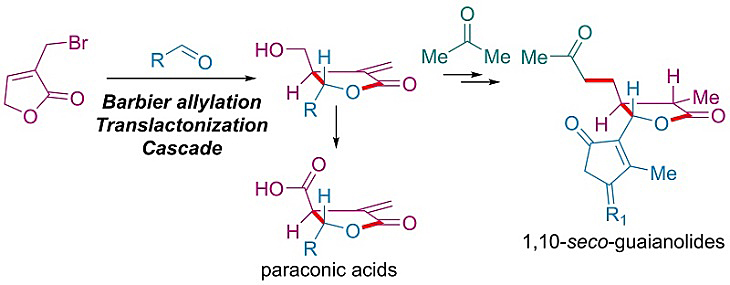
图2. paraconic acids及开环愈创木内脂的合成。
高雅支内酯具有杀虫、抗炎、抗肿瘤、抗高尿酸血症等多种活性,结构上多个Michael受体皆有可能与氨基酸残基发生亲核反应。然而究竟谁才是反应的活性位点?活性的分子基础为何?目前还未可知。对高雅支内酯裸露羟基直接炔丙基修饰虽然很容易得到分子探针,但分子结合蛋白的能力却随之消失。因此基于全合成的分子探针被从源头合成。对细胞裂解液进行探针标记,并通过点击化学连接荧光染料或者生物素继而进行凝胶电泳顺利地标记到了高雅支内酯的靶蛋白,靶点垂钓和质谱分析成功发现了核转运蛋白IPO5(图3)。

图3. 高雅支内酯靶点确认。
进一步的竞争实验表明高雅支内酯与靶蛋白的结合具有高度的特异性。通过对所有的合成化合物及多种类型倍半萜内酯进行测试,结果表明只有高雅支内酯和atripliciolide能够特异性结合IPO5(图4)。
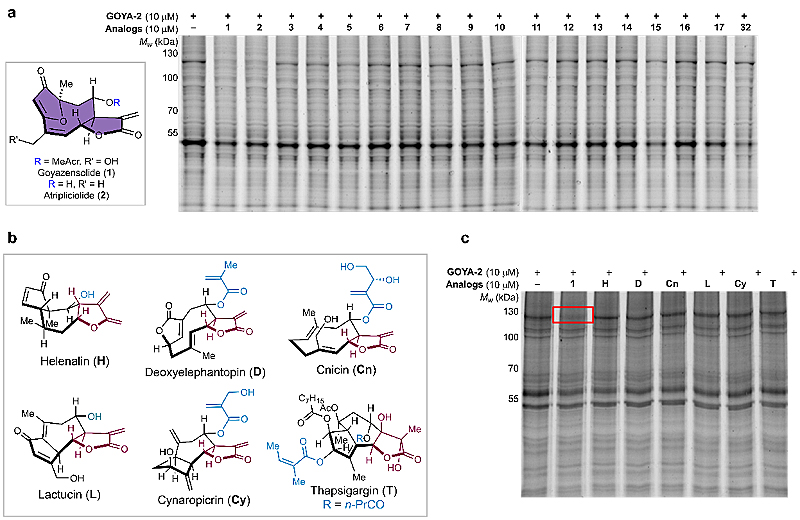
图4. 竞争实验。
作为输入蛋白家族中重要的成员之一,IPO5能帮助具有核定位序列(NLS)的蛋白质转运入核,在病毒蛋白的入核及病毒感染过程中起着至关重要的作用。通过合成两种生物素化的核定位序列并进行测试,结果表明高雅支内酯能够有效地抑制IPO5与艾滋病病毒及甲型流感病毒核定位序列的相互作用(图5),揭示了该化合物重要的抗病毒活性,值得注意的是,同样作用于核转运蛋白的药物伊维菌素对新冠病毒复制有抑制作用。
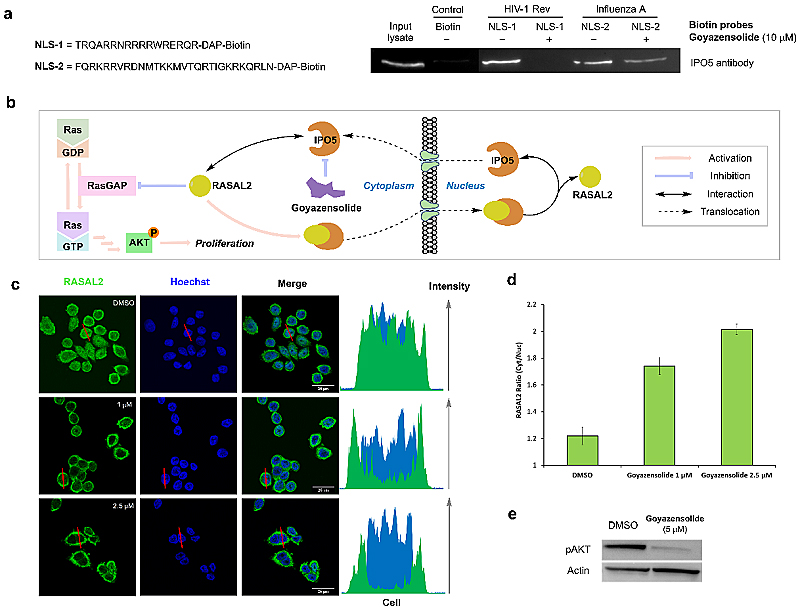
图5. 高雅支内酯功能及作用机制。
此外,IPO5被报道可以通过介导RASAL2核转运,促进结直肠癌细胞增殖和迁移。通过对细胞与天然产物进行孵育并检测RASAL2的分布,结果显示高雅支内酯能通过共价连接IPO5进而干扰IPO5介导的RASAL2转运入核,对RAS通路重要蛋白表达产生影响(图5),进而体现出抗肿瘤活性。与新近获批全新靶点的抗癌新药selinexor有异曲同工之妙。
这一成果近期被发表在ACS Central Science 上,[1]并以“First Reactions”的形式在同期进行了亮点介绍,[2]该文章也很快将以封面的形式呈现。开环愈创木内脂类倍半萜的合成已于近期发表在了Organic Letters 上。[3]
相关文章:
1. Liu, W., Patouret, R., Barluenga, S., Plank, M., Loewith, R., Winssinger, N. Identification of a Covalent Importin-5 Inhibitor, Goyazensolide, from a Collective Synthesis of Furanoheliangolides. ACS Cent. Sci., 2021, DOI: 10.1021/acscentsci.1c00056
2. Hoock, J. G. F., Laraia, L. Unravelling the Mode of Action of Furanoheliangolides through Total Synthesis and Chemical Proteomics. ACS Cent. Sci., 2021, DOI: 10.1021/acscentsci.1c00542
3. Liu, W., Yu, Z., Winssinger, N. Total Syntheses of Paraconic Acids and 1,10-seco-Guaianolides via a Barbier Allylation/Translactonization Cascade of 3-(Bromomethyl)-2(5H)-furanone. Org. Lett., 2021, 23, 969-973.
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号