武汉大学周强辉课题组Chem:利用轴到轴手性转移的策略高效构建C–N轴手性化合物
轴手性骨架是一类非常重要的结构单元,广泛存在于具有生物活性的天然产物、药物分子、手性材料以及手性配体和催化剂中。其中,C–C联芳基轴手性化合物的合成研究已经得到了长足的发展,而C–N轴手性化合物的不对称合成研究则相对较少,其原因主要是与前者相比,C–N轴具有较高的旋转自由度和较低的构象稳定性,从而导致该类化合物的不对称合成具有很大的挑战。自2002年Taguchi和Curran小组分别报道了第一例钯催化的N-烯丙基化反应,不对称合成C–N轴手性苯胺类化合物以来,一些有效的合成C–N轴手性骨架的方法相继被开发出来(图1B)。目前,已发展的不对称合成方法主要包括以下5种:(1)直接不对称构建阻旋C–N轴;(2)苯胺化合物的不对称N–H键官能团化;(3)C–N键邻位C–H键的不对称官能团化;(4)不对称从头构建其中的一个芳环;(5)对称苯胺化合物的去对称化。尽管C–N轴手性的构建已经取得了一定的发展,但在反应效率、底物普适性和产物多样性等方面仍有很大的改进空间。因此发展高效、简洁的合成新方法,利用简单易得的原料合成C–N轴手性化合物仍然是轴手性化学领域的研究热点及难点。
武汉大学化学与分子科学学院周强辉教授课题组一直致力于有机功能分子的高效合成研究,近年来在钯/降冰片烯协同催化(Catellani反应)合成多取代芳烃领域取得了一系列研究进展。2020年,该课题组发展了钯/手性降冰片烯协同催化高效构建联芳基轴手性化合物的模块化策略(Nat. Catal., 2020, 3, 727–733)。随后,他们利用该协同催化策略实现了1,2-双轴手性三联苯化合物的构建(J. Am. Chem. Soc., 2021, 143, 7253−7260)和叔苄醇消旋体的高效动力学拆分(Angew. Chem. Int. Ed., 2021, 60, 12824–12828)。在此研究基础上,最近他们又发展了独特的轴到轴手性转移(axial-to-axial chirality transfer)策略高效构建更具挑战的C–N轴手性(图1C),并与浙江大学洪鑫教授合作通过DFT理论计算揭示了反应的机理和手性转移的过程。相关成果发表在Chem 上。
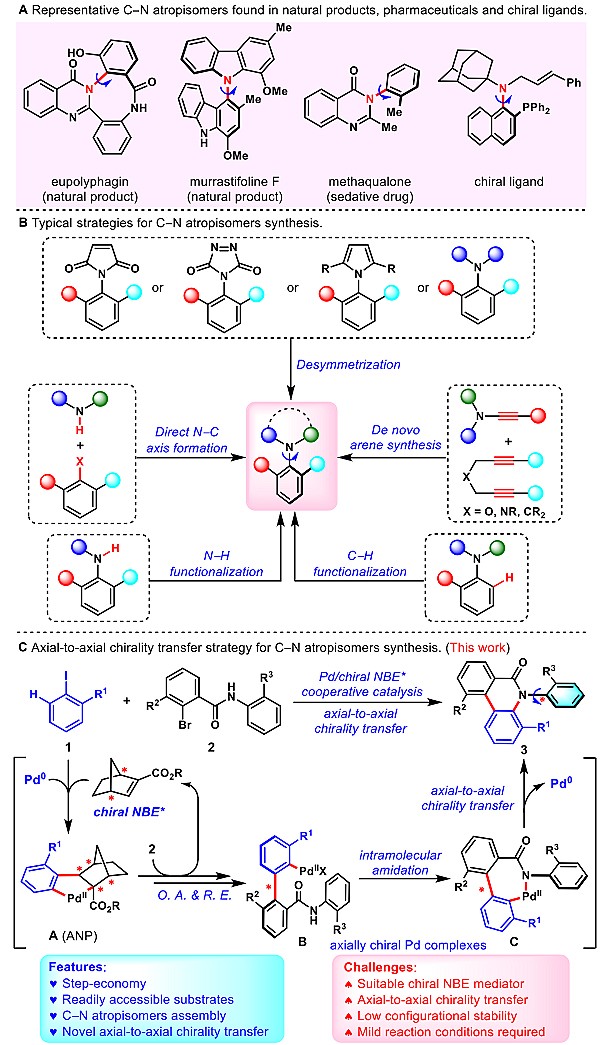
图1. C–N轴手性化合物的应用及合成方法
作者以邻甲基碘苯(1a)和2,6-二取代的芳基溴(2a)作为模板底物,对反条件应进行了大量的筛选,并得出最优的反应条件为:10 mol%醋酸钯为催化剂,22 mol% 三(2-呋喃基)膦为配体,50 mol%手性降冰片酸甲酯(N1*)为助催化剂,碳酸钾为碱,乙腈为溶剂,于70 ℃反应36小时(图2)。可以以91%的分离产率和92%的对映选择性得到目标C–N轴手性产物3a。
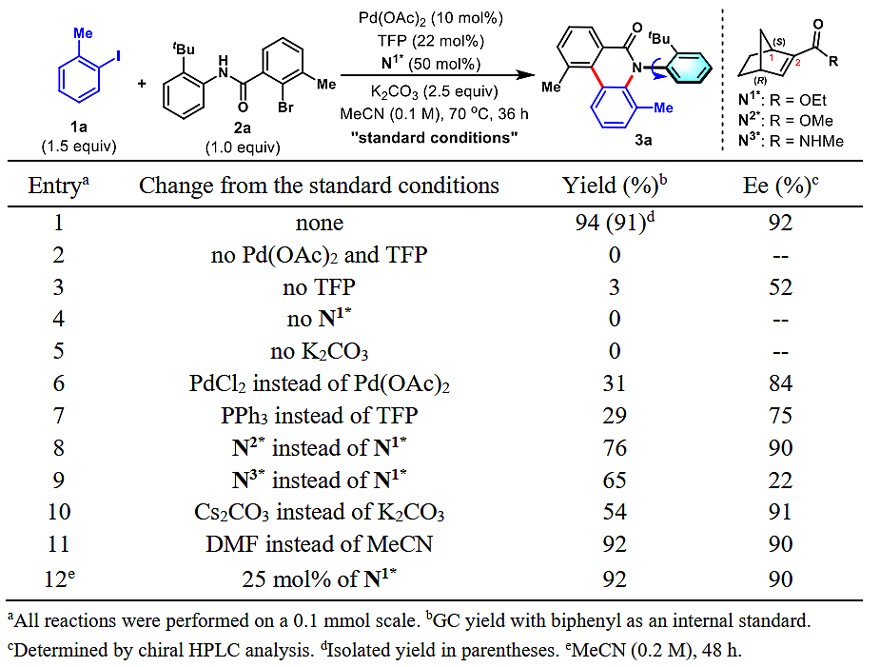
图2. 反应条件的筛选
在最优的反应条件下,作者首先对芳基碘化物的适用范围进行了考察(图3)。实验结果表明,芳环上不同位置以及不同电性的取代基均可以很好的兼容该反应,以良好到优秀的收率(42%-96%)和优秀的对映选择性(87%-98%)得到C–N轴手性菲啶酮产物(3a-3y)。值得一提的是,间位取代的芳基碘化物在Catellani芳基化反应中往往是比较差的一类底物,在该反应中也能以优秀的区域选择性和对映选择性得到单C–H芳基化的产物(3p-3r)。此外,杂芳基碘化物也有很好的反应效果(3y)。

图3. 芳基碘化物的适用范围
随后,作者考察了芳基溴化物的底物适用范围(图4)。除甲基外,芳基溴化物的邻位取代基还可以扩展到氯(3A)、硝基(3B)和萘基(3C)。芳基溴化物中苯胺所在苯环的4位也可以兼容多种官能团,如苯基(3E)、溴原子(3D)、醛基(3F)、烯基(3G)、炔基(3H)等。值得一提的是,这些官能团很容易进行进一步转化。在苯胺邻位取代基的考察中,作者发现一般需要较大空间位阻的基团以确保产物C–N轴的稳定,当把邻位的叔丁基换成位阻稍小的基团时,所得产物几乎没有ee值(3N-3P),有趣的是,当使用间位取代的芳基碘化物与这些底物反应时,能够以非常好的区域选择性和对映选择性得到目标产物(3Q-3V)。此外,该反应还具有很好的化学选择性,当底物中含有多个碳–卤键反应位点时,反应只发生在吸电子酰胺基团的邻位(3D,3U和3V)。

图4. 芳基溴化物的适用范围
为了解释前面提到的有趣的取代基效应对C–N轴手性构象稳定性的影响,作者进行了DFT理论计算(图5)。正如预料那样,当苯胺邻位的取代基位阻减小后,产物的旋转能垒确实急剧下降(3a vs 3aa)。出乎意料的是,芳基碘化物上的取代基在邻位比在间位时所得到的产物的旋转能垒低(3a vs 3a'、3R' vs 3R、3Q' vs 3Q)。作者以化合物3Q' 和 3Q为例解释了产生该现象的原因:DFT最优结构显示,甲基在邻位时,甲基与苯胺的苯环之间具有较大的空间位阻排斥作用,导致空间结构发生较大扭曲,二面角增大(20.8° vs 12.2°),使得化合物3Q' 比3Q的C–N轴更容易旋转,从而旋转能垒降低(25.9 vs 33.0 kcal/mol)。为了进一步探究产物的构象稳定性,作者还进行了热消旋化实验(图5B)。结果表明化合物3a只有在温度低于70 ℃时才能够保持构象稳定。此外,脱除化合物3I的TBS保护基后,在室温下即发生部分消旋,进一步于70 ℃温度下加热3小时后则完全发生消旋。这些实验说明苯胺邻位取代基的位阻对稳定C–N轴手性具有重要作用。

图5. 产物构象稳定性研究
此外,作者也对该反应的应用潜力进行了研究(图6)。首先,该反应可以顺利放大到克级规模,而且手性降冰片烯的用量可以降低到25 mol%,反应效率和对映选择性都没有影响,反应结束后还可以以71%的回收率回收手性降冰片烯(图6A)。其次,利用双碘化物作为底物可以实现两次C–H芳基化反应,得到远程双C–N轴手性产物(图6B)。另外,所得的C–N轴手性产物3V可以与邻位取代的苯硼酸在非常温和的反应条件下发生Suzuki偶联反应,以良好的非对映选择性得到具有相邻C–N和C–C轴的双轴手性产物(图6C)。最后,所得的C–N轴手性产物3L和3M在叔丁醇钠的作用下发生分子内的酯交换反应,得到同时拥有手性C–N轴的十元及十一元环大环内酯化合物(图6D)。

图6. 合成应用研究
为了探究反应的机理及手性转移的过程,作者进行了详细的DFT理论计算研究(图7),对整个反应所经历的三个过程包括手性ANP中间体的形成、C–C轴手性的形成和C–N轴手性的形成开展了细致的能量分析,并推断反应的决速步是四价钯中间体还原消除生成二价钯中间体的过程。此外,DFT理论计算很好的解释了所形成的C–C轴手性中间体的构型以及后续通过轴手性转移形成C–N轴手性的立体信息传递以及构型控制过程。这些DFT理论计算的结果与实验数据很好的吻合。
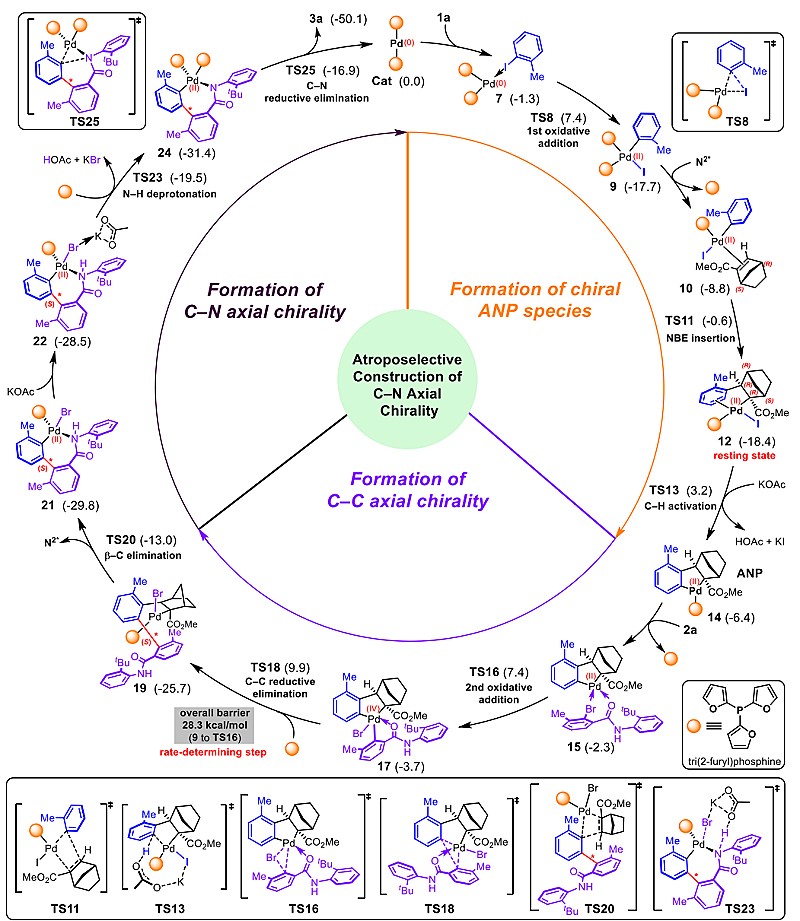
图7. 反应机理及手性转移过程的DFT理论计算
总结
钯/手性降冰片烯协同催化促进的不对称Catellani反应是一个极具挑战性的全新研究领域,目前仅有少数的研究报道。周强辉课题组通过钯/手性降冰片烯协同催化,利用独特的轴到轴手性转移(axial-to-axial chirality transfer)的策略实现了极具挑战的C–N轴手性的高效构建,所得的C–N轴手性起源于预先形成的C–C轴手性。该策略采用易得的芳基碘化物和芳基溴化物作为原料,在钯/手性降冰片烯的协同催化下,以高达97%的收率和99%的对映选择性得到一系列结构多样化的C–N轴手性菲啶酮类化合物(44个例子)。该反应具有原料廉价易得、底物适用范围广、化学选择性好、对映选择性高、易于放大等优点。该方法还可以很方便地构建远程或相邻的双轴手性化合物。此外,DFT计算详细阐述了该反应的机理和手性转移过程,为进一步不对称催化研究提供了理论依据。
这一成果于近期发表在Chem,武汉大学周强辉教授和浙江大学洪鑫教授为论文的共同通讯作者,武汉大学博士后刘泽水和浙江大学博士研究生谢培培为论文的共同第一作者。这项研究得到了国家自然科学基金和武汉大学人才基金的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

An axial-to-axial chirality transfer strategy for atroposelective construction of C–N axial chirality
Ze-Shui Liu, Pei-Pei Xie, Yu Hua, Chenggui Wu, Yuanyuan Ma, Jiangwei Chen, Hong-Gang Cheng, Xin Hong, Qianghui Zhou
Chem, 2021, DOI: 10.1016/j.chempr.2021.04.005
周强辉教授课题组:
http://qhzhou.whu.edu.cn/?lang=en
https://www.x-mol.com/groups/QianghuiZhou
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号