氧原子连接的手性环戊二烯基铑络合物合成及在不对称C−H活化中的应用
近年来,手性环戊二烯基铑络合物催化的不对称C−H官能团化反应在有机合成中已经取得了重要进展。但手性环戊二烯基的设计与合成是一个重要挑战。目前,在已报道的手性环戊二烯基配体中,其手性骨架与茂环通常是由碳原子连接,而且合成相对困难且步骤繁琐。发展合成路线简单的新型手性环戊二烯基配体具有重要的意义。
近期,中国科学院上海有机化学研究所的游书力研究员(点击查看介绍)课题组合成了基于联二萘酚骨架的新型手性环戊二烯基配体(BOCp),其铑络合物可以高效催化不对称碳氢键活化反应。催化的苯并[h]喹啉与重氮化合物的C−H偶联反应,可以以优秀的收率和对映选择性得到轴手性联杂芳基化合物。

作者从相对廉价的(R)-BINOL从发,以钴催化的分子内[2+2+1]环化反应为关键步骤得到环戊二烯酮中间体(R)-IV,然后与一系列的金属试剂发生加成反应生成环戊二烯基醇中间体(R)-VII,再还原羟基得到多取代手性环戊二烯配体(BOCp) (R)-VIII。最后环戊二烯配体发生金属化获得BOCpRh络合物,总共6−8步,对比相应的碳连接Cp配体,合成路线大大缩短。在苯并[h]喹啉与重氮化合物的不对称C−H偶联反应中,与文献已知的CpRh络合物相比,BOCpRh催化剂可以取得更加优秀的对映选择性控制。
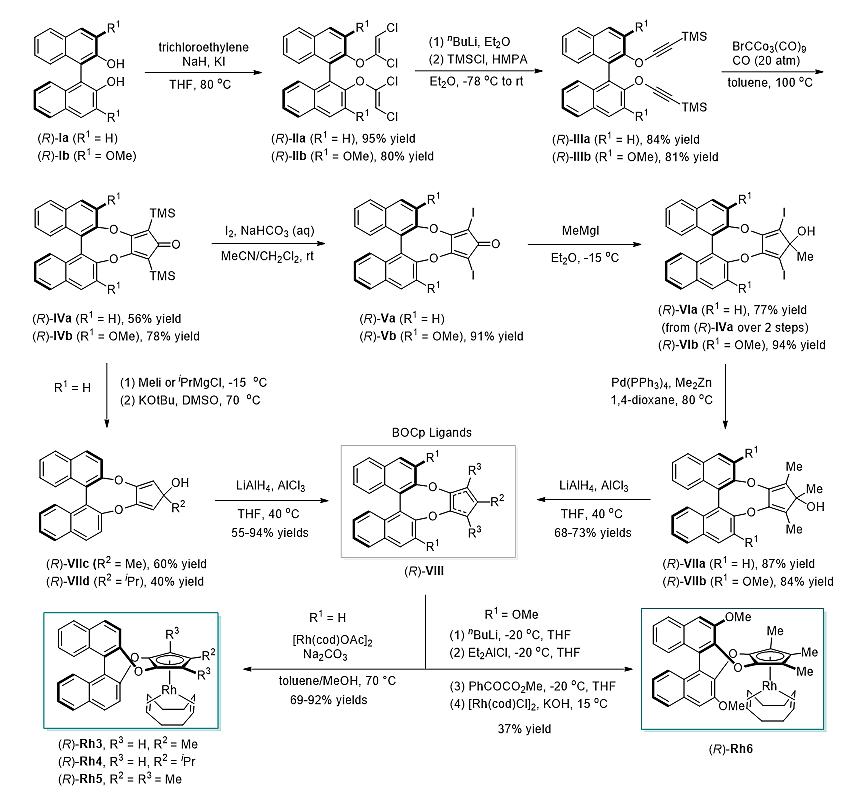
在最优条件下,作者对苯并[h]喹啉化合物以及重氮化合物的适用范围进行了考察。实验结果表明,反应对于各种取代的苯并[h]喹啉和重氮化合物都能得到比较好的结果,富电子重氮化合物具有更高活性。
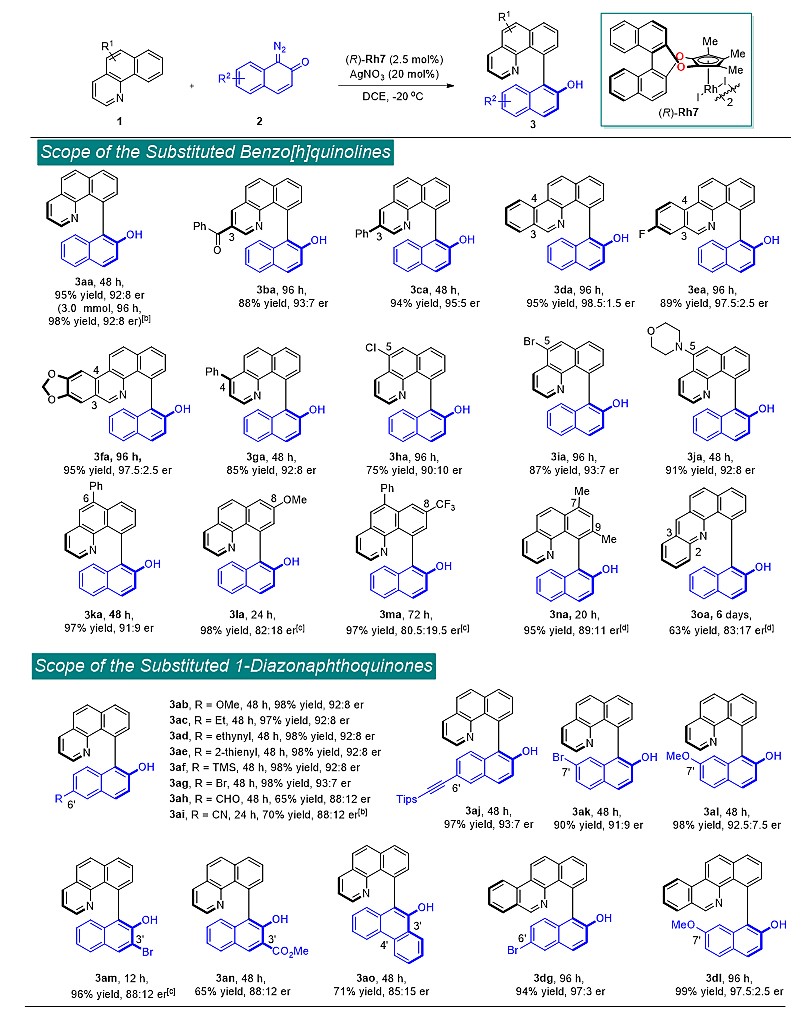
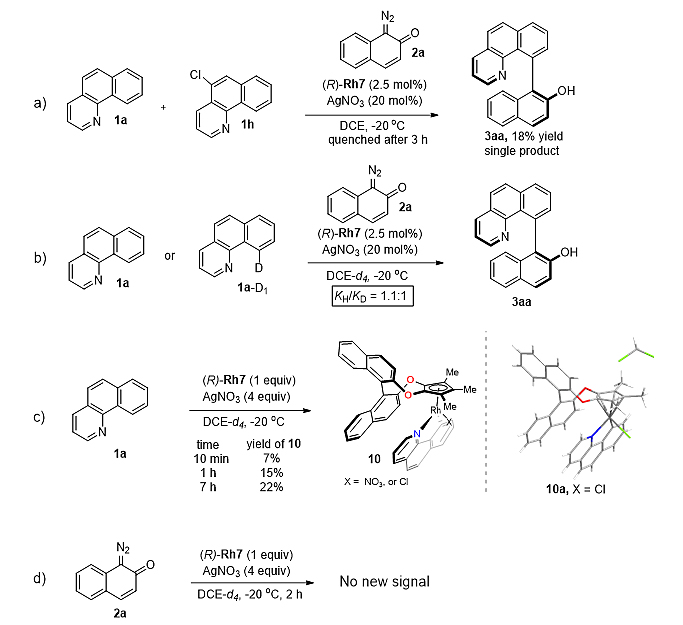
克级实验和产物衍生化实验也展示该反应的实用性,另外产物3aa有着较高的消旋化能垒,轴手性比较稳定(160 ℃,ΔG⧧ = 37.6 kcal/mol, 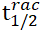 = 96 h)。
= 96 h)。
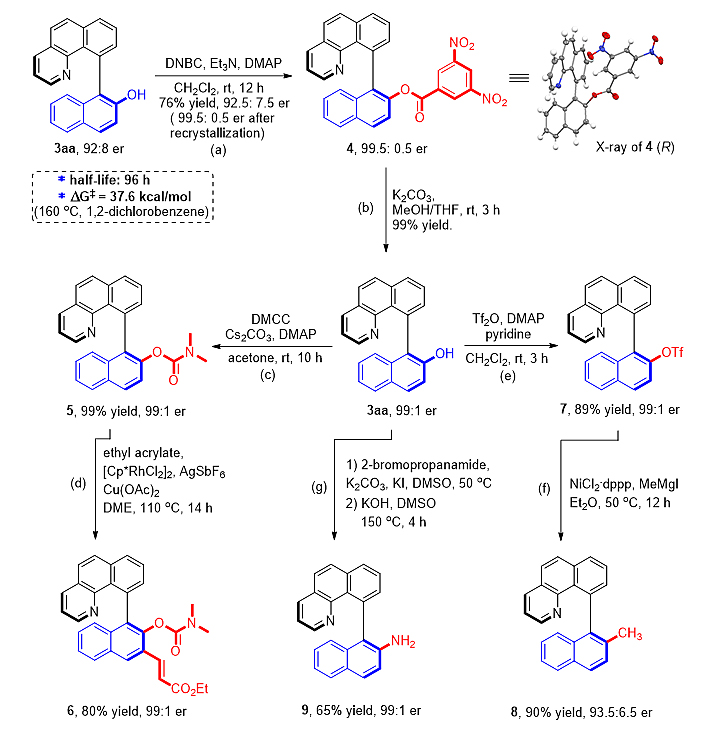
最后作者对反应机理作了较为深入的研究。不同电性的苯并[h]喹啉化合物与重氮化合物2a的竞争实验表明,该反应可能经过亲电型C−H键活化过程。KIE实验表明C−H键活化可能不是该反应的决速步。接着作者使用原位的核磁实验检测反应的过程,在不加入重氮化合物2a时,苯并[h]喹啉1a与当量的Rh7在标准条件下反应10分钟,可以检测到7%的环铑物种10a,7小时后收率为22%,在10a单晶结构中,较大位阻的卤素远离空间屏蔽的联二萘酚骨架;另一方面,在标准条件下,当量的Rh7不能够与重氮化合物2a发生反应,从而排除了金属卡宾直接的C−H键插入过程。
小结
游书力课题组发展了新型手性氧原子连接的环戊二烯基铑络合物(BOCpRh)催化苯并[h]喹啉与重氮化合物不对称C−H芳基化反应,可以高效构建一系列轴手性联杂芳基化合物。机理研究表明,苯并[h]喹啉首先与CpRh络合物经过亲电型的C−H键活化形成环铑物种,之后与重氮化合物发生偶联反应。该项工作为发展新型不对称碳氢键官能团化反应提供了新催化剂选择。相关研究结果近期发表在Angew. Chem. Int. Ed.期刊上。文章的第一作者是博士后潘重庆,通讯作者是游书力研究员。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Oxygen‐linked Cyclopentadienyl Rh(III) Complexes‐Catalyzed Asymmetric C−H Arylation of Benzo[h]quinolines with 1‐Diazonaphthoquinones
Chong-Qing Pan, Si-Yong Yin, Shao-Bo Wang, Qing Gu, Shuli You
Angew. Chem. Int. Ed., 2021, DOI: 10.1002/anie.202103638
导师介绍
游书力
https://www.x-mol.com/university/faculty/15598
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号