靶向拓扑异构酶1与c-MYC G-四链体的双靶点小分子化合物在三阴性乳腺癌治疗中的应用
三阴性乳腺癌具有进展迅速、侵袭性强、预后差等特点,其转移风险、复发率及5年病死率均远高于非三阴性乳腺癌。就现阶段而言,三阴性乳腺癌的治疗方法主要是化疗、手术治疗及放射治疗等。然而,化疗存在预后不理想、无复发生存率较低、毒副作用较大等问题。另外,高剂量的化疗药物往往能够导致肿瘤耐药。目前,多重耐药是三阴性乳腺癌治疗最大的挑战之一,它有可能导致化疗失败及肿瘤复发。因此,寻找新型有效的三阴性乳腺癌治疗药物具有重大的意义。
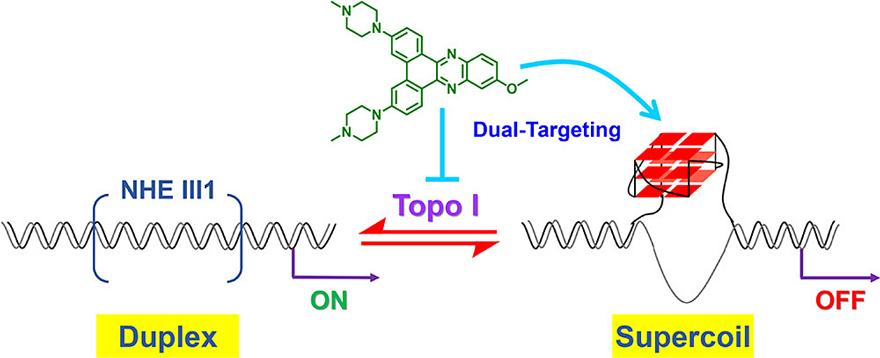
研究表明,在三阴性乳腺癌中,癌基因c-MYC通路高度上调,与癌症的发展恶化、转移以及化疗耐药密切相关。c-MYC基因的转录调控非常复杂。其中,转录诱导的DNA负超螺旋(supercoils)起着重要的调控功能。转录开始时,结合蛋白SP1与启动子NHE III1区双链DNA结合,启动c-MYC转录。随着转录的进行,累积的负超螺旋可以促使NHE III1的富鸟嘌呤单链形成一种名为G-四链体的特殊核酸二级结构,进而导致SP1等蛋白无法与DNA结合,转录停止。然而,肿瘤细胞中过度表达的拓扑异构酶1(Topo1)能够解开负超螺旋,释放扭曲应力,从而促使G-四链体转变为双链DNA,再一次激活c-MYC转录。因此,抑制Topo1及稳定c-MYC G-四链体的双靶点小分子化合物可能可以更好地抑制三阴性乳腺癌的生长,降低肿瘤耐药性的产生。
近日,深圳大学医学部药学院胡命豪副教授(点击查看介绍)以该课题组前期发展的喹喔啉骨架为基础(Nucleic Acids Res., 2019, 47, 10529),进行巧妙的结构微调(苯环的桥联),设计合成了一系列二苯并喹喔啉类化合物,使其具有同时抑制Topo1解超螺旋活性及c-MYC转录活性的潜力。接着,研究组对这些化合物进行了系统的构效关系研究,并从中筛选出具有最佳活性的化合物(编号5)进行深入评价。在体外的活性研究中,化合物5不仅能够有效地抑制Topo1的催化活性,而且能够较强地稳定c-MYC G-四链体,进而抑制c-MYC的表达,诱导周期阻滞及细胞凋亡。值得一提的是,化合物5在三阴性乳腺癌的小鼠模型中也表现出了良好的抗肿瘤活性,而且其毒副作用明显低于传统化疗药物。该项研究为三阴性乳腺癌的治疗提供了新思路。
这一成果近期发表在Journal of Medicinal Chemistry 上。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

New Dibenzoquinoxalines Inhibit Triple-Negative Breast Cancer Growth by Dual Targeting of Topoisomerase 1 and the c-MYC G-Quadruplex
Ming-Hao Hu* and Jia-Hong Lin
J. Med. Chem., 2021, DOI: 10.1021/acs.jmedchem.0c02202
胡命豪博士简介

胡命豪,深圳大学医学部药学院副教授,硕士生导师。2017年获中山大学药物化学博士学位,随后进入深圳大学工作。课题组长期致力于靶向特殊核酸二级结构G-四链体的小分子化合物的开发,主要包括:(1)开发具有新型化学骨架、具有较大成药潜力的先导化合物;(2)开发靶向G-四链体结构的功能性小分子化合物;(3)探究G-四链体小分子配体在难治性肿瘤、耐药性肿瘤上的应用。在Nucleic Acids Res.,J. Med. Chem.,Eur. J. Med. Chem.,Anal. Chem.,Chem. Commun.等国际期刊上发表多篇研究性论文。
https://med.szu.edu.cn/Item/5044.aspx
https://www.x-mol.com/university/faculty/91965
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号