好文再读:去对称C-H键活化实现不对称甲基化
在药物分子合适的位置仅仅引入一个甲基,有时能够将活性提高100倍以上。然而,选择性地活化C-H键引入甲基一直都是有机化学领域一个比较困难的课题。大约三分之二的药物分子中甲基的引入都需要使用具有强亲核性的Me-X试剂(X = I、OTf、+OMe2等)。近年来,相关文献报道了通过醇、过氧化物、亚磺酸锌等试剂作为甲基自由基前体发生自由基调控的C-C键偶联反应,但是不对称的甲基化反应依然是一个难点。本篇Angew Highlight由来自美国俄亥俄州立大学的David A. Nagib教授(点击查看介绍)撰写,文中主要介绍了近期美国斯克里普斯研究所的余金权(Jin-Quan Yu)(点击查看介绍)课题组通过催化的C-H键活化去对称化的方法实现对映选择性的甲基化反应(Science, 2017, 355, 499)。该论文X-MOL之前也做过解读(点击阅读详细),这次我们从Nagib教授的角度再次阅读这篇好文。
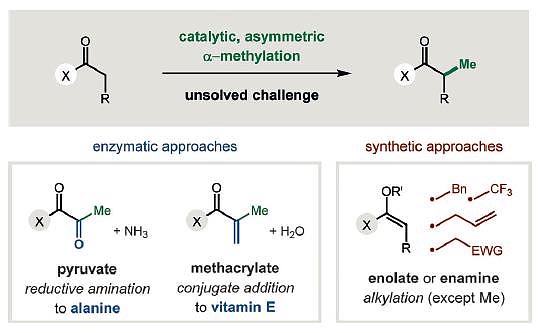
图1. 羰基的不对称α-甲基化。图片来源:Angew. Chem. Int. Ed.
不对称甲基化中一个现实的问题是如何实现氨基酸的不对称α-甲基化反应。人们一直期待丙氨酸可以通过甘氨酸的酶促反应得到,然而这一过程是通过丙酮酸的不对称还原胺化实现,底物需要预先进行甲基修饰,难以通过不对称C-C键偶联实现甲基化(图1)。类似的,维生素E的合成也是在甲基预先修饰的前提下通过C=C双键与水共轭加成得到,而不是通过C-C键偶联实现不对称甲基化。
传统的从头合成实现不对称烷基化主要通过Lewis酸、相转移催化剂、光氧化还原剂、有机分子等催化剂实现羰基的α-烷基化(包括烯丙基化、苄基化等)以及β-EWG-烷基化。然而通过C-C偶联的方式实现不对称甲基化的过程依然是一个难题,往往需要通过迂回的策略首先进行不对称磺酰亚甲基化(-CH2SO2R),然后去磺酰化得到不对称甲基化产物。
在此背景下,余金权课题组报道了Pd催化的羰基β-H活化反应,实现了C-C键的不对称甲基化(图2)。为了实现前手性的异丙基去对称化得到异丁酸盐,他们设计了一种新的催化剂,在之前发展的β-H活化反应中,在酰胺上引入更大位阻的烷基,可以很好地区分甲基的C-H键。然而在该反应中,区分甲基的C-H键并非决定性问题,更为关键的是如何有效地区分异丙基的两个甲基,使用之前β-H活化反应中最优的催化体系只能得到消旋的β-H甲基化产物。

图2. 去对称的立体选择性甲基化。图片来源:Angew. Chem. Int. Ed.
通过理论计算和合理的设计,经过一系列的配体筛选后,余金权教授等人发现具有流线型的α-氨基噁唑啉配体具有最好的活性(图3)。含有双手性中心骨架结构的配体在手性控制方面具有更好的效果,当缺少其中一个手性中心时,反应的对映选择性大大下降(6%, 14%),而当两个手性中心结合作用时,反应具有非常高的选择性(96%)。
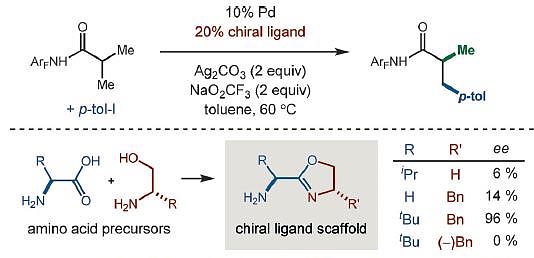
图3. 催化剂的设计。图片来源:Angew. Chem. Int. Ed.
完成了初步探索之后,作者对底物的普适性进行考察。余金权教授等人完成了40个底物的拓展,电子效应、空间位阻等对反应的影响较小,碘苯等高活性的底物也能够很好地兼容(图4)。除此之外,他们还拓展了超过20种β-C-H键烯(炔)化反应的底物,最终得到γ,δ-不饱和酰胺化合物,这也充分说明α-氨基噁唑啉配体具有良好的催化活性。
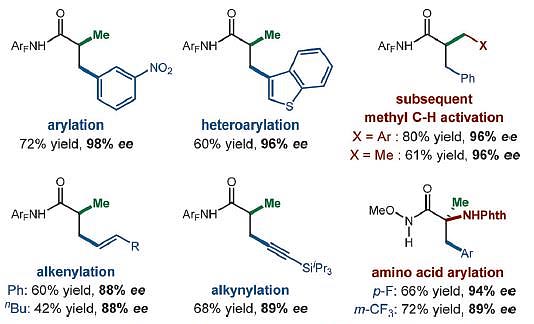
图4. 底物普适性研究。图片来源:Angew. Chem. Int. Ed.
——小结——
通过β-C-H键去对称化策略,余金权课题组实现了直接构建具有α-甲基的手性碳中心,该反应条件温和,具有良好的底物普适性。毫无疑问,这样的合成策略解决了以往难以攻克的问题,但该反应还存在一些需要改进的地方:1) 全氟芳基(ArF)酰胺是完成该催化循环必不可少的官能团,构建复杂;2) 后续反应需要使用BF3•Et2O消除保护基等。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Catalytic Desymmetrization by C-H Functionalization as a Solution to the Chiral Methyl Problem
Angew. Chem. Int. Ed., 2017, DOI: 10.1002/anie.201703311
导师介绍
David A. Nagib
http://www.x-mol.com/university/faculty/1644
余金权
http://www.x-mol.com/university/faculty/694
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号