“镁”力不打折(shé):Nature报道超纳米双相超强镁合金
生物医用金属材料作为在临床实验中成功的外科植入材料,目前已在骨钉、骨板以及髓内针等骨内固定器械中取得了广泛的应用。金属材料应用于生物医疗领域必须严格满足一些生物学需求:首先,它需要具备良好的组织相容性,不会产生过敏及免疫排异反应,在固定骨骼的同时不破坏临近的组织;其次,该材料需具备相对稳定的物理化学性质,除了在强度、弹性等方面满足一定的要求,还需要耐腐蚀、耐磨耗且无生物毒性。另外,这种金属材料还应易于加工成型,以方便不同情况的需求。以下这张表格反映了不同骨骼植入材料的力学性质,相比于传统的不锈钢、钛合金等材料,镁合金应用于这一领域存在着诸多不可比拟的优势。对比相关参数,镁具有与人体骨骼最吻合的力学性能,可以提供稳定的骨愈合环境,减少外源材料植入带来的负面影响。
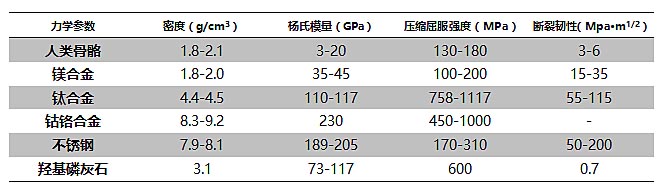
不同植入材料的力学参数
镁还是人体所需的大量元素,几乎参与体内所有的新陈代谢过程,过量的镁可通过尿液排出体外,在适当的代谢条件下不会对人体造成不良的影响。除此之外,镁在生物体内可以逐步降解,不需要手术拆除,避免了二次手术带来的损伤。然而,镁合金作为生物医用材料还存在许多需要改进的地方,其中一个需要考虑的问题便是如何使实际生产中得到的镁合金强度更加接近理论强度。以往的制备方法主要通过控制其晶界缺陷来阻止位错运动,从而提高镁合金的强度。然而这种“晶界加强”的方法不能无限制地使用,例如工业生产中的单向纳米晶合金可通过加强这一效应得到理想的强度,但当晶粒尺寸过小、晶界缺陷控制不当时,材料在承受相对低的应力(小于杨式模量的2%)时便发生软化变形,失去了其本来的目的。
最近,香港城市大学的吕坚教授团队报道了一种改进策略,他提出“超纳米尺寸双相玻璃晶”(supra-nanometre-sized dual-phase glass-crystal,SNDP-GC)合金的概念,其中“超纳米”意味着该材料中不同相单元的尺寸都小于10 nm,该方法将非晶化层与纳米晶体结构结合,产生在室温条件下接近理想强度的双相材料,其极限应力高达3.3 GPa,是迄今为止强度最高的镁合金材料,研究成果发表于Nature 上。

吕坚教授(前左)、吴戈博士(论文一作,前右)手持新型材料与其他团队成员合影。图片来源:刘昀/新华社
由于非晶材料不存在晶界缺陷问题,镁合金非晶化则成为另一种提高其强度的方法,该过程将位错运动模式转变为剪切变形,通常情况下比相应的晶体形态具备更高的强度。然而,在非晶化变形中常常不可避免地带来剪切带软化效应,使其极限应力仍旧不超过杨氏模量的2%。吕坚教授则通过磁控溅射法制备得到了非晶/纳米晶双相结构镁合金,他将直径约6 nm的MgCu2晶粒均匀地嵌入约2 nm厚的镁基非晶层中,一次溅射工艺可以沉积得到具有10 cm×10 cm大面积、10 μm厚度的均匀薄膜。
随后他利用高分辨率透射电子显微镜(HRTEM)观察到6 nm的纳米晶粒均匀分散在非晶化基质中,显示出非晶/纳米晶双相结构。他们同样发现这一MgCu2纳米晶体具有低位错密度,表现出低能态稳定性。该SNDP-GC的平均组成为Mg49Cu42Y9,MgCu2的体积分数为56%。

SNDP-GC的HRTEM成像。图片来源:Nature
为了确定这种SNDP-GC的基本机械性能,他们首先在不同材料中引入纳米级压痕,测试得到其硬度为6.5±0.1 GPa,远高于传统的非晶化镁合金(3.6 GPa)。他们还利用原位扫描电子显微镜(SEM)的微压缩试验对这种材料的机械响应能力进行考察,相比之下,SNDP-GC镁合金的极限应力为3.3 GPa,达到其杨式模量的4.5%,接近其理论强度(约杨式模量的5%)。值得注意的是,合金的杨氏模量会随着其组成发生变化。SNDP-GC镁合金仍旧保留了镁合金较低杨式模量的性质,与常规的纳米晶或非晶化镁合金相当,但其强度却得到了大大的提高。
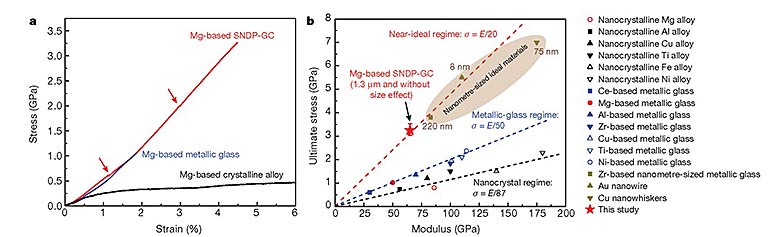
不同合金在室温下的机械性能。图片来源:Nature
作者还通过本构模型分析验证了该SNDP-GC材料的变形机制,即受MgCu2纳米晶粒剪切带的抑制作用,初级剪切带大量增加,纳米晶体发生塑性变形。
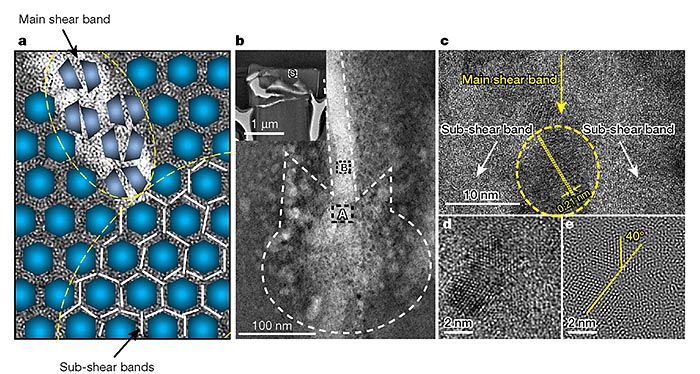
SNDP-GC的变形机制。图片来源:Nature
——总结——
超纳米尺寸“非晶/纳米晶”双相镁合金的设计无疑在镁合金的性能提升上做出了很大的贡献,这种改性将会使镁合金在生物医用金属材料中取得更为广泛的应用。除此之外,这项工作同样展示了可以通过可控的方式生产超纳米结构的方法,为其它合金材料的开发设计提供了指导意义。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Dual-phase nanostructuring as a route to high-strength magnesium alloys
Nature, 2017, DOI: 10.1038/nature21691
(本文由夜若岚尘供稿)
