有机所汤文军教授:关于手性苯并氧杂膦烷配体的设计和应用

手性配体的结构对过渡金属催化的不对称反应活性和立体选择性有着至关重要的影响。
由中国科学院上海有机化学研究所汤文军教授课题组研究的基于苯并手性氧杂膦烷结构单元的膦能够满足不对称氢化、不对称偶联、不对称亲核加成等一系列不对称催化反应的要求,为新型不对称催化反应的开发和实现药物绿色制造提供有效工具和解决方案。
一、手性苯并氧杂膦烷配体概述
苯并氧杂五元膦烷是刚性、稳定、又容易修饰的结构单元,基于此类骨架的膦配体具有成为优势配体的潜力(图1)。当苯并氧杂膦烷中的磷原子上装上一个大位阻取代基(如叔丁基)时,该类配体表现出稳定的P-手性。具体来讲,这些膦配体在不对称催化中表现以下多个特点:(1)配体中的苯并氧磷杂五元环的刚性结构使其具有确定的构象,保证了在催化反应中催化剂与底物作用时具有确定的优势面和劣势面,从而可以有效通过结构改造调节催化反应的活性和立体选择性;(2)磷原子上的供电子取代基可以让这类配体更加富电性,提高金属催化剂的氧化能力;叔丁基取代保证了配体的大位阻性能;P-手性特征使手性环境更加靠近过渡金属中心,实现很好的手性诱导;(3)通过改变配体中R1、R2以及R3的结构可以对配体的电性及位阻进行有效调控,从而优化配体的催化活性和选择性;(4)苯并氧杂膦烷配体一般是室温下空气中稳定的固体,便于工业化应用和操作。

图1. 苯并氧杂五元膦烷结构的特点
基于上述特点,一系列的手性单、双、P,P=O型的配体相继推出,构筑成一个琳琅满目,功能多样的膦手性配体库。图2中列出了经典的基于苯并氧杂膦烷结构的P-手性单膦和双膦配体,其中单膦配体BI-DIME、AntPhos、BaryPhos、P,P=O等在过渡金属钯催化的不对称Suzuki-Miyaura偶联和分子内去芳构环化反应中显示出优异的催化特性,一系列手性药物包括布洛芬、氟比洛芬、萘普生、雷公藤对醌H和棉酚等手性联芳基药物可以很高效地合成出来。手性双膦配体BIBOP、POP、WingPhos、BABIBOP等则出色应用于Rh催化的不对称氢化和加成反应中,表现出高立体选择性和反应效率,并高效应用于托法替尼、艾司西酞普兰和Cipargamin的高效合成中。[1]
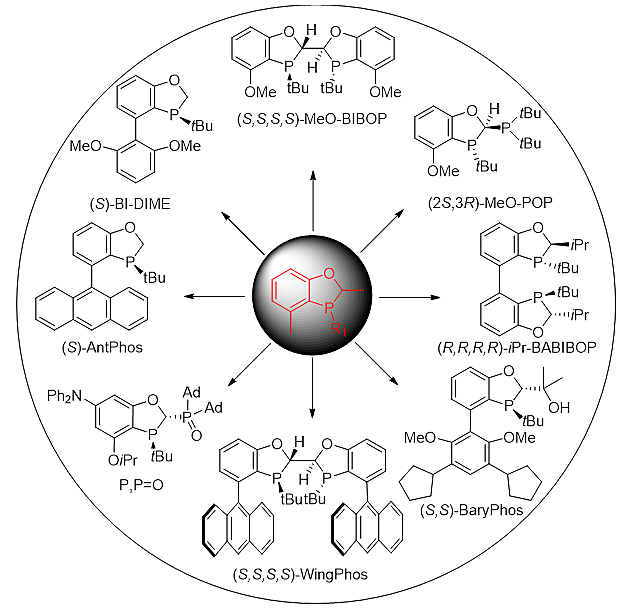
图2. 一些基于手性苯并氧杂五元膦烷的配体
二、基于手性苯并氧磷杂五元环的配体简介
一)双膦配体简介
基于苯并氧磷杂五元环刚性骨架的双膦配体有三种类型(图3):具有C2对称性的BIBOP类型配体I、具有C2对称性的联芳基BABIBOP类型配体II和具有不同磷“环境”的POP类型配体III。芳环的引入使这一类配体具有很好的空气稳定性。由于具有联芳基结构,BABIBOP类型配体II有着和BIBOP类型配体I截然不同的空间构型,因而也表现出和配体I互补的催化活性。POP类型的配体III,由于两个磷原子的连接基团不同,使得其在一些反应的催化活性比BIBOP和BABIPOP要高。值得指出的是,手性双膦配体I、II和III同样具有结构和电性可调的特点,通过改变配体中R3、R4或R5基团可以有效地对配体的催化活性进行优化。
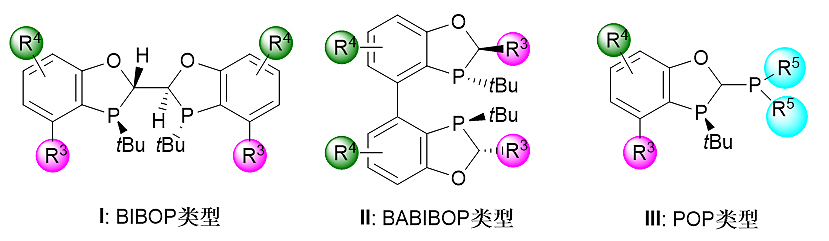
图3.手性双膦配体类型简介
1. BIBOP类型配体
在已开发的结构迥异、琳琅满目的手性双膦配体中,BIBOP型手性双膦配体的可修饰性很强,这种强可修饰性表现在能够通过简单修饰后,在许多不对称催化反应中表现出强大的功能。BIBOP型结构使其在众多的不对称催化反应中表现出优异的对映选择性和效率。在此向从事不对称催化和合成的研究人员强烈推荐BIBOP类型配体,这类配体应该是研究人员手性工具箱中不可缺少的一员。
以下是BIBOP类型作为配体参与的不对称催化反应实例:
1)1,1-二取代和四取代烯酰胺的不对称氢化[2][3]
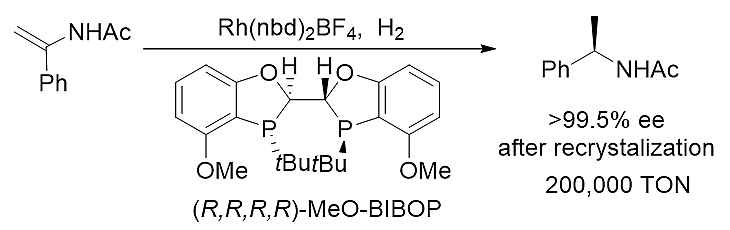
图式1. 超高转化数的1,1-二取代烯酰胺的不对称氢化反应
MeO-BIBOP在铑催化的1,1-二取代烯酰胺不对称氢化反应中表现出优秀的催化活性和立体选择性。超高效的催化效率(高达200000 S/C比率)至今仍然是烯酰胺不对称氢化中的最高纪录。
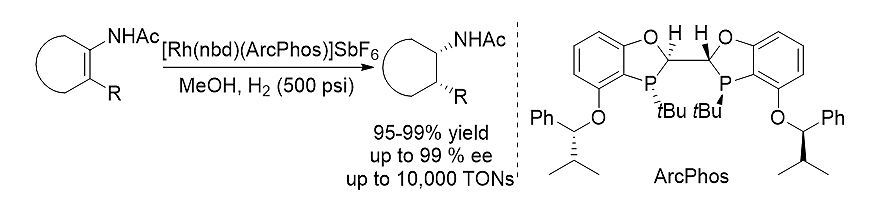
图式2. BIBOP型双膦配体ArcPhos参与的四取代烯酰胺的高效不对称氢化
ArcPhos在铑催化的四取代烯酰胺不对称氢化反应中表现出优秀的催化活性和立体选择性。一系列手性四取代氢化产物例如顺-2-烷基取代的碳环或杂环胺衍生物可以通过此方法高产率高立体选择性地得到。令人欣喜的是,该配体也表现出很高的催化效率(高达10000 S/C比率),并且成功应用于Janus激酶抑制剂托法替尼的立体选择性合成中。
2)芳基硼酸酐对无保护靛红亚胺的不对称亲核加成反应 [4]
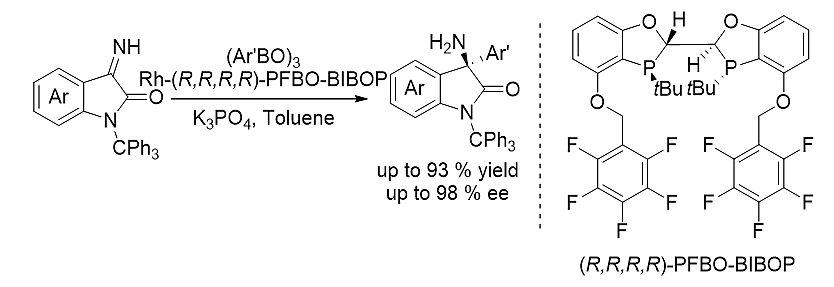
图式3. BIBOP型PFBO-BIBOP双膦配体参与的不对称亲核加成反应
PFBO-BIBOP在芳基硼试剂对无保护靛红亚胺不对称亲核加成反应表现出高立体选择性,得到一系列具有潜在药用价值的手性α-三级胺产物。这一方法成功地应用于抗疟疾活性分子Cipargamin的立体选择性合成。
2. WingPhos: 一个结构独特而又多功能的手性双膦配体
纵观已经发展的数千种结构迥异、琳琅满目的手性双膦配体中,WingPhos配体具有非常鲜明、独特的立体结构特征,其在许多不对称催化反应中表现出独树一帜的功能。跟其他手性双膦配体如MeO-BIBOP、BIBOP相比,WingPhos配体结构好似在催化金属中心附近装上了两个蒽基基团,从而使该配体表现出很深的手性口袋,将金属中心深深地埋在两个蒽基平面的中间。(图4)由于这两个蒽基片段象两片翅膀,因此该配体命名为WingPhos。当底物靠近该金属催化剂时,底物将首先和蒽基基团发生作用。WingPhos独特的结构使其在众多的不对称催化反应中表现出非凡的对映选择性和效率。在此向从事不对称催化和合成的研究人员强烈推荐WingPhos配体,这个配体应该是研究人员手性工具箱中不可缺少的一员。
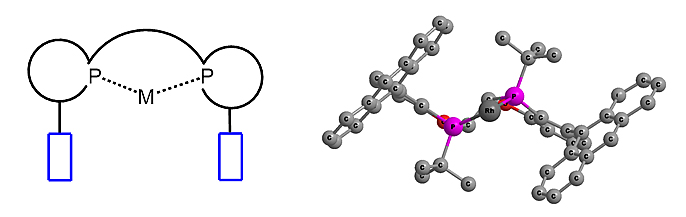
图4. 金属Rh-WingPhos的络合物
以下是WingPhos作为配体参与的不对称催化反应实例:
1)三取代烯酰胺的不对称氢化 [5]
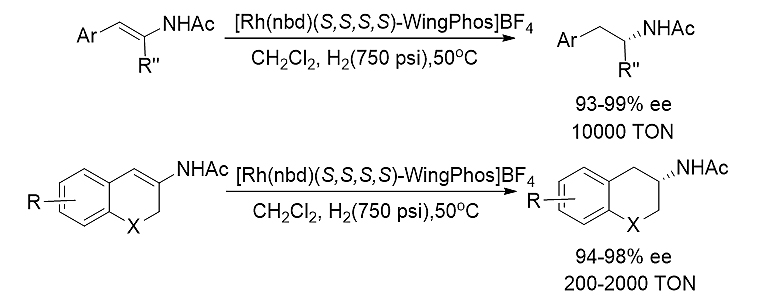
图式4. WingPhos参与的三取代烯酰胺的高效不对称氢化反应
在(E)-β-芳基-N-乙酰烯酰胺、环状β-芳烯酰胺和杂环β-芳烯酰胺的铑催化不对称氢化反应中,WingPhos表现出优秀的催化活性和立体选择性。一系列手性β-芳基异丙基胺、手性2-氨基四氢满萘和手性3-氨基苯并二氢吡喃均以优良的对映选择性和催化效率(高达10000 S/C比率)顺利获得。
2)芳基硼酸酐对芳基酮的不对称加成 [6]
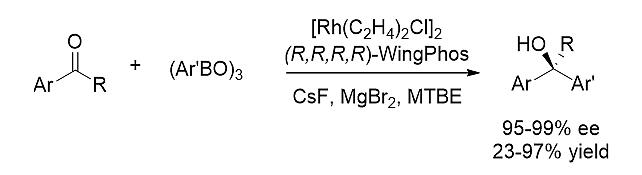
图式5. WingPhos参与的芳基硼酸酐对芳基烷基酮的不对成亲核加成
铑-WingPhos催化剂成功促进芳基硼酸酐对芳基烷基酮的不对称加成反应,一系列手性双芳基烷基醇类化合物均以高对映选择性和高收率地顺利制备。这一方法学也成功地应用于抗抑郁药物分子艾司西坦普兰的对映选择性合成中。
3)芳基硼酐对N-H芳基酮亚胺的不对称加成 [4]
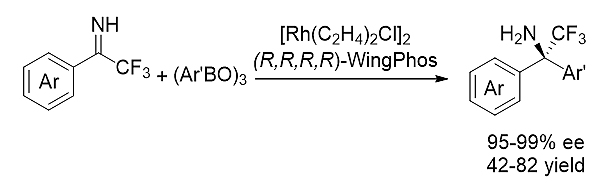
图式6. WingPhos参与的芳基硼酸酐对N-H芳基酮亚胺的不对成亲核加成
铑-WingPhos催化剂也成功实现了芳基硼酸酐对N-H芳基酮亚胺的高效不对称加成反应,为系列手性α-三氟甲基-α,α-双芳基胺类化合物的合成提供了一种简单实用的方法。该反应立体选择性好,收率优良,铑金属用量最低只需1% 摩尔百分比。
4)不对称大环环化反应 [7]
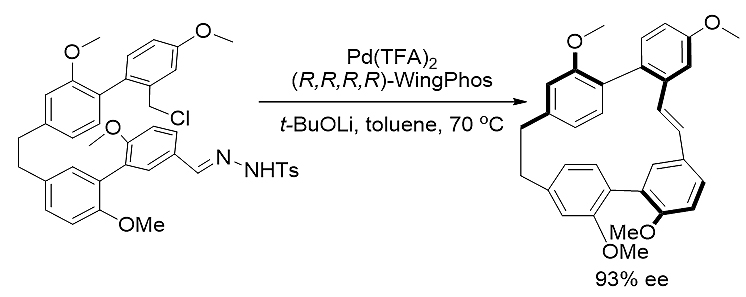
图式7. WingPhos参与的不对称大环环化反应
中国科学技术大学顾振华教授利用Pd-WingPhos催化体系成功实现了分子内苄氯与卡宾之间高对映选择性的大环环化反应,其所得的环化产物对映选择性高达93% ee。
5)串联烯丙基化取代反应 [8]
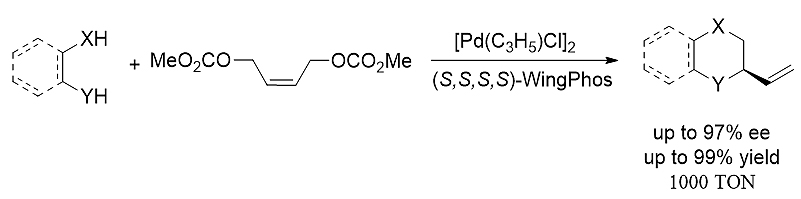
图式8. WingPhos参与的不对称串联烯丙基化取代反应
利用钯-WingPhos催化剂,高立体选择性的二碳酸丁烯二酯的串联烯丙基双取代反应也顺利实现。一系列含有手性的杂环类化合物包括四氢喹啉、哌嗪、二氢-2H-苯并[b][1,4]-恶嗪以及吗啉均以高光学纯度和优良收率顺利得到。
6)不对称氢甲酯化反应[9]
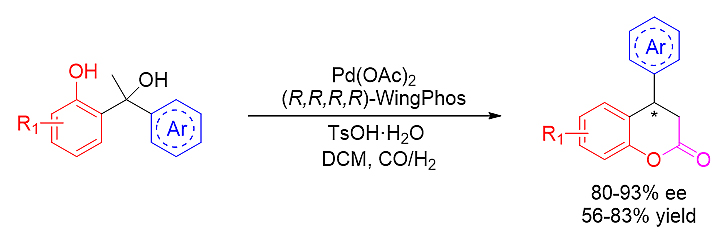
图式9. WingPhos参与的不对称氢甲酯化反应
利用Pd-WingPhos催化剂,成功实现了二芳基甲醇的高效不对称氢甲酯化反应,并以高对映选择性和良好的收率得到一系列手性4-芳基-3,4-二氢香豆素化合物。
3. POP型
POP型手性双膦配体的可修饰性强,由于三个叔丁基的存在使得其空间位阻很大,在不对称氢化反应中表现出强大的功能。在此向从事不对称催化和合成的研究人员强烈推荐POP类型配体,这类配体应该是研究人员手性工具箱中不可缺少的一员。
以下是MeO-POP作为配体参与的不对称催化反应实例[10]:
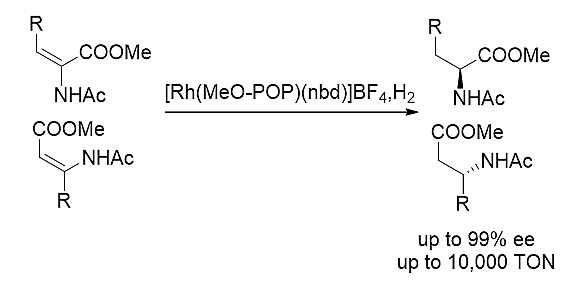
图式10. MeO-POP参与的三取代烯酰胺不对称氢化反应
MeO-POP在铑催化三取代烯酰胺不对称氢化反应表现出优异的催化活性和立体选择性。一系列手性三取代氢化产物可以通过此方法学高产率高立体选择性得到,许多情况下ee>99%。并且令人欣喜的是,该配体表现出很高的转化数(高达10000 S/C比率)。
4. BABIBOP型
和前面介绍的双膦配体不同的是,BABIBOP型手性双膦配体由于在结构连接方式上的不同,导致其在不对称催化反应中表现出非常不同的特点。这个类型的配体已经在不对称氢化反应中表现出强大的功能。
以下是BABIBOP作为配体参与的不对称催化反应实例[11]:
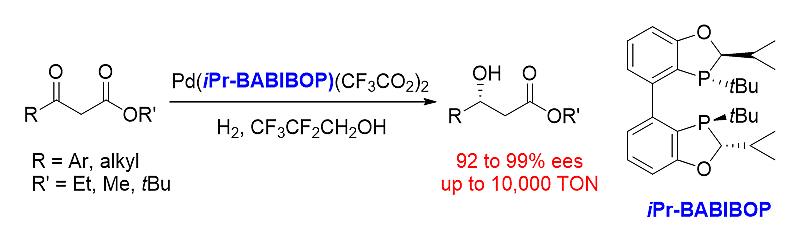
图式11. iPr-BABIBOP参与的β-酮酸酯的不对称氢化
iPr-BABIBOP能够实现钯催化的β-酮酸酯的不对称氢化反应,其表现出优秀的催化活性和立体选择性。一系列手性β-羟基羧酸产物可以通过此方法高产率和高立体选择性地得到,S/C比率高达10000。
二)单膦配体简介
基于苯并氧杂五元磷烷刚性骨架的单膦配体有二种类型(图4):具有联芳基型的BI-DIME类型配体I和具有P,P=O结构单元的配体II。芳环的引入使这一类配体具有很好的空气稳定性。值得指出的是,手性单膦配体I和II同样具有结构和电性可调的特点,通过改变配体中R1~R5基团可以有效地对配体的催化性能进行优化。
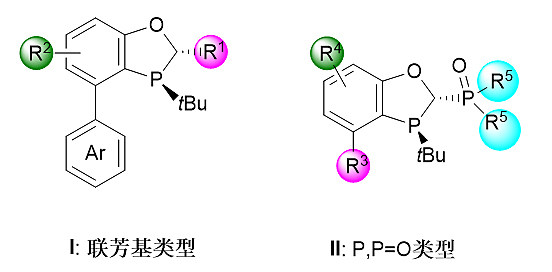
图5. 基于手性苯并氧杂膦烷的手性单膦配体
5. BI-DIME 类型配体
BI-DIME类型是一个联芳基单膦配体,具有以下四方面的显著特征:1)BI-DIME具有刚性的苯并氧杂膦环和叔丁基结构,是个构象确定、大位阻、富电子的单膦配体;2)分子结构具有膦手性;3)下边的芳环有很强的修饰性,有利于提高催化剂的反应活性和对映选择性;4)BI-DIME是操作简便、在空气中稳定的固体,非常适合工业化应用。
BI-DIME类型的配体在众多催化反应中表现出了较好的反应活性,以下是BI-DIME类型配体的几个应用例子:
1)大位阻Suzuki-Miyaura偶联反应 [12][13]
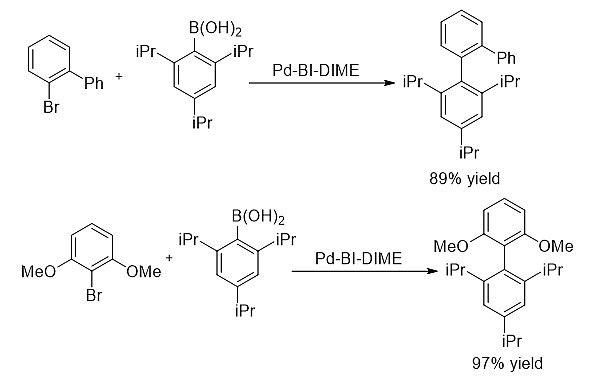
图式12. BI-DIME参与的大位阻芳基-芳基偶联反应
BI-DIME配体在钯催化大位阻偶联反应中表现出优秀的催化活性。一系列大位阻联芳基化合物均可高产率地合成。
2)不对称Suzuki-Miyaura偶联构建邻位三取代轴手性化合物 [14]
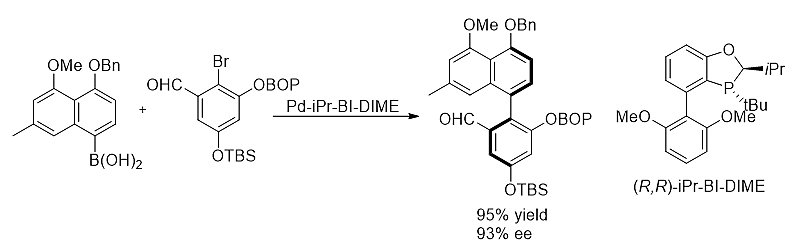
iPr-BI-DIME在钯催化不对称芳基芳基偶联构筑邻位三取代轴手性化合物中表现出优秀的催化活性和立体选择性。一系列手性偶联产物可以通过此方法学高产率和高立体选择性地得到。该方法首次成功地应用于手性联芳基类天然产物科鲁普钩枝藤碱A和B、以及马歇尔碱B的高效不对称合成中。
3)不对称硼氢化反应 [15]
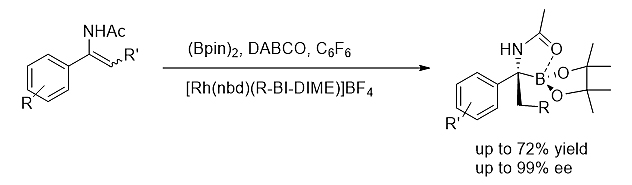
手性BI-DIME配体在不对称铑催化三取代烯酰胺的硼氢化反应中表现出优秀的催化活性和立体选择性。一系列手性α-氨基硼酸可以通过此方法学高产率和高立体选择性地得到。
4)1,1-二取代联烯的不对称双硼化[16]
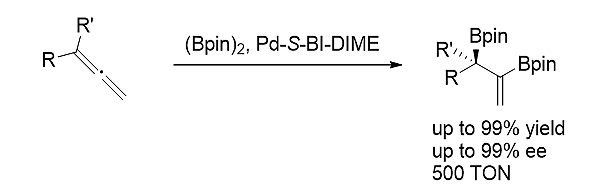
手性BI-DIME配体在不对称钯催化1,1-二取代联烯的双硼化反应中表现出优秀的催化活性和立体选择性。一系列手性双硼产物均可以通过此方法高产率和高立体选择性地得到。
5) 不对称α-芳基化反应[17]
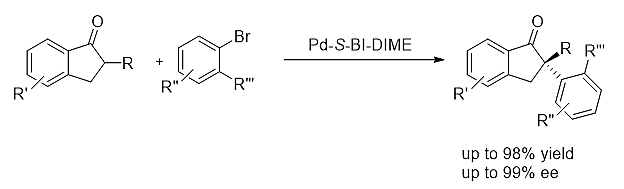
手性BI-DIME配体在钯催化茚酮的不对称α-芳基化反应中表现出优秀的催化活性和立体选择性,高立体选择性地合成一系列含手性季碳中心的芳酮结构。此方法成功应用于抗抑郁药物(S)-萘苯诺酮的高效合成中。
6. AntPhos
AntPhos是一个大位阻的联芳基单膦配体,具有以下四方面显著的特征:1)AntPhos具有刚性的苯并氧杂膦环和叔丁基结构,是个构象确定、大位阻、富电子的单膦配体;2)分子结构具有膦手性;3)下边蒽环中大π体系可以和催化金属中心配位,有利于提高催化剂的效率、延长催化剂的寿命;4)AntPhos是操作简便、在空气中稳定的固体,非常适合工业化应用。Antphos在众多催化反应中表现出了较好的反应活性,以下是Antphos的几个应用例子:
1)Miyaura硼化反应。相比于其他可以应用的膦配体,AntPhos在Miyaura硼化反应中展示出底物适用范围广,官能团兼容性好等优势。AntPhos尤其适合于大位阻、官能团化的芳基硼酸制备。[18]
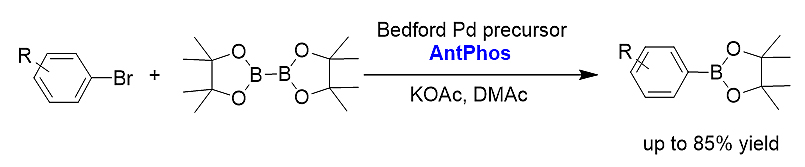
2)大位阻Suzuki-Miyaura偶联反应。AntPhos适合各种官能团化、不同位阻的偶联反应,包括邻位单取代、双取代、三取代、四取代和含各类杂环的联芳基化合物的制备。
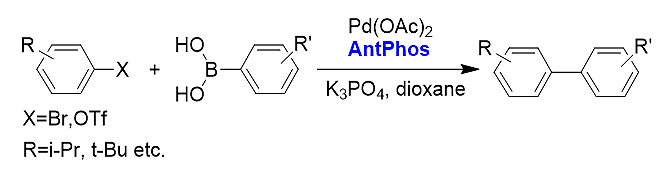
3)芳基烷基间Suzuki-Miyaura偶联。偶联产物中的R基团可为各种常见官能团,环状化合物可以是环丙烷至环庚烷等化合物,反应收率高,为各种芳基取代的环状化合物提供了有效的合成方法。[19]
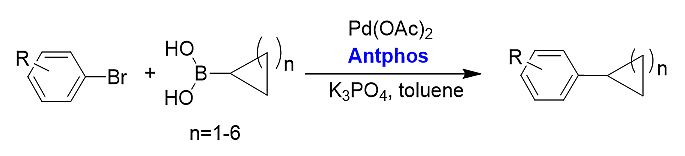
4)超催化剂量的Suzuki偶联反应。Antphos在该例偶联反应中的催化效率TONs高达40000,即催化剂使用量仅为四万分之一,大幅度降低了钯催化剂的用量以及生产成本。
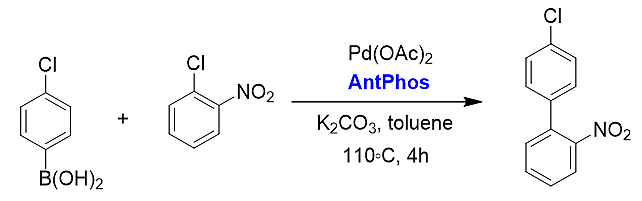
手性AntPhos也已广泛应用于各种不对称催化反应中,下面是几个代表性的应用例子。
1) 镍催化不对称环化。手性AntPhos能高效地促进镍催化炔酮的不对称还原环化,高立体选择性和高收率地合成含四氢呋喃环的手性烯丙醇。[20]
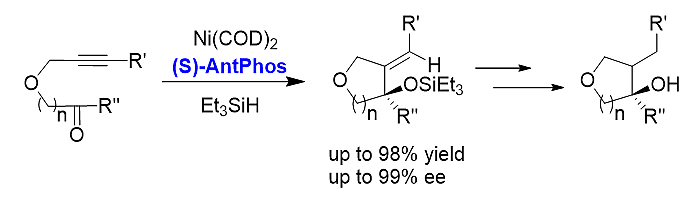
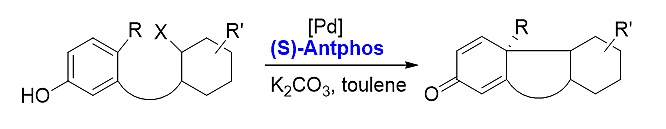
2) 不对称去芳构环化。手性AntPhos在不对称去芳构化反应中,手性AntPhos表现出良好的区域选择性和较高的光学纯度,且收率良好,为非甾体药物合成提供了全新思路,同时也为该类新药发现提供了一条便捷途径。[21][22]
3) 不对称Heck反应
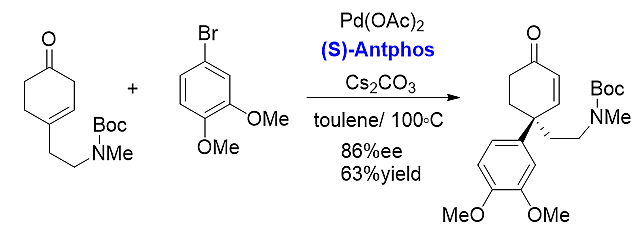
在上述一例手性季碳原子构建案例中,手性Antphos表现出优异的反应活性,后续进一步修饰转化即可得到天然产物松叶菊碱。由此可见,在构建手性季碳中心这一关键步骤中手性Antphos具有无法比拟的优势。[23]
4) 分子内的不对称烯烃芳氧化
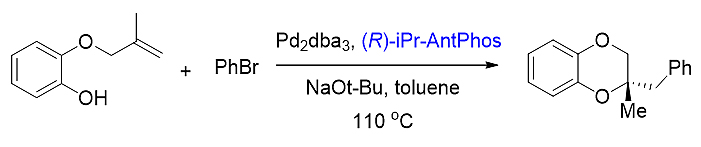
这一例分子内不对称烯烃芳氧化串联反应中,手性AntPhos表现出优秀的反应活性,丰富的催化底物结构,光学纯度高等优势。再则,对AntPhos结构进行进一步修饰合成iPr-AntPhos,其反应的催化活性和对映选择性又进一步得到提升。[24]
7. P,P=O 配体
P,P=O配体是一类具有P,P=O结构单元的大位阻手性膦配体。其结构特点是在BI-DIME型配体和AntPhos配体的基础上引入了一个大位阻、弱配位的P=O结构单元。此类含有弱配位的大位阻单膦配体可以有效地抑制-氢消除或二次转金属化。其原理是弱配位点P=O的引入,不仅有助于促进还原消除,同时有效占有了钯中心周围的其他配位位点,从而有效抑制β-消除、异构化和还原脱卤等副反应。
以下是P,P=O型配体的几个应用例子:
1)大位阻的芳基-烷基偶联反应 [25]
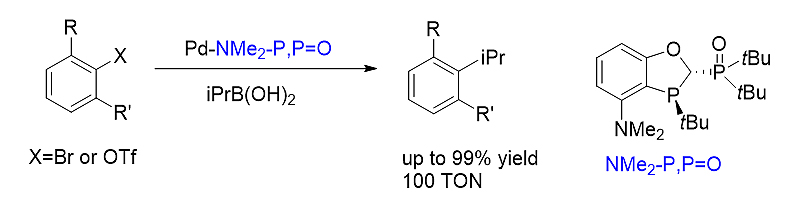
P,P=O配体有效促进了钯催化的大位阻芳基烷基偶联反应,表现出优秀的催化活性和区域选择性。一系列偶联产物可以通过该方法高产率和高区域选择性地得到。该方法顺利应用于男性避孕药棉酚的骨架合成中。
2)不对称α-溴代酰胺和芳基硼酸偶联反应 [26]
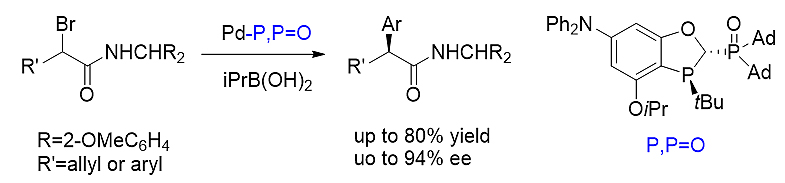
手性的P,P=O配体有效促进了钯催化的不对称α-溴代酰胺和芳基硼酸之间的偶联反应,并表现出优秀的催化活性和立体选择性。一系列α-芳基酰胺产物都可以通过该方法高产率和高立体选择性地得到。此方法被应用于布洛芬、萘普生、氟比洛芬的高效合成中。
8. BaryPhos
BaryPhos是BI-DIME型配体中一支异军突起的新型手性单膦配体。与之前的BI-DIME和iPr-BI-DIME配体相比,联芳基的下半部分结构庞大,增加了配体整体的空间位阻效应。另外,配体中的三级醇结构也为偶联反应中转金属和立体选择性控制所需的氢键作用提供便利。
以下是BaryPhos配体的应用举例[27]:
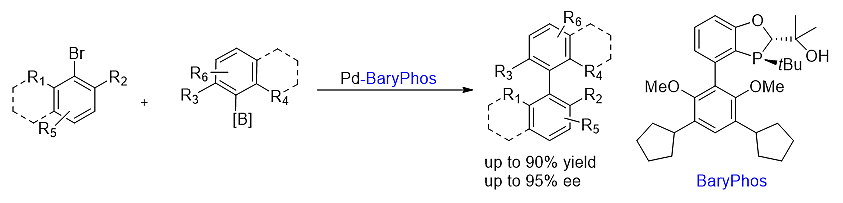
BaryPhos配体有效促进了钯催化的不对称邻位四取代芳基芳基偶联反应,表现出优秀的催化活性和立体选择性。一系列手性联芳基化合物可以通过该方法高产率和高选择性地合成得到。此方法已成功应用于男性避孕药物棉酚的对映选择性合成中。
综上所述,一系列基于手性苯并氧杂五元膦烷、具有重要应用价值的单、双膦配体已经研制成功。这些配体琳琅满目,结构多样,功能高效,能够满足不对称氢化、不对称偶联、不对称亲核加成等一系列不对称催化反应的要求,为新型不对称催化反应的开发和实现药物绿色制造提供有效工具和解决方案。

参考资料:
[1] a) Chin. J. Org. Chem., 2020, 14, 581; b) Acc. Chem. Res., 2019, 52, 1101−1112; c)Aldrichimica Acta, 2020, 53, 27-35
[2] Org. Process Res. Dev., 2013, 17, 1061–1065;
[3] Angew. Chem., Int. Ed., 2019, 58, 13573-13583
[4] Angew. Chem. Int. Ed., 2019, 58, 16119-16123
[5] Angew. Chem. Int. Ed., 2013, 52, 4235-4238.
[6] Angew. Chem. Int. Ed., 2016, 55, 4527-4531.
[7] Chin. J. Chem., 2020, 38, 1081-1085.
[8] Org. Lett., 2020, 22, 4483-4488
[9] Angew. Chem. Int. Ed., 2021,doi: 10.1002/anie.202015450
[10] Org. Lett., 2010, 12, 1104-1107
[11] Chin. J. Chem., 2018, 36, 153-156
[12] Angew. Chem. Int. Ed., 2010, 49, 5879-5883
[13] Chem. Eur. J., 2013, 19, 2261-2265
[14] J. Am. Chem. Soc., 2014, 136, 570–573
[15] J. Am. Chem. Soc., 2015, 137, 6746-6749
[16] Chem. Sci., 2017, 8, 5161-5165
[17] Angew. Chem. Int. Ed., 2018, 55, 5044–5048
[18] Org. Lett., 2011, 13, 1366-1369
[19] Org. Chem. Front., 2014, 1, 225-229
[20] Angew. Chem. Int. Ed., 2015, 54, 2520-2524
[21] Angew. Chem. Int. Ed., 2015, 54, 3792-3796
[22] Chem. Sci., 2017, 8, 6247-6256
[23] J. Org. Chem., 2016, 81, 10165-10171
[24] Angew. Chem. Int. Ed., 2016, 55, 5044–5048
[25] a) Angew. Chem. Int. Ed., 2015, 54, 3792-3796; b) Org. Biomol. Chem., 2017, 15, 9903-9909
[26] a) Angew. Chem. Int. Ed., 2019, 58, 11355-11359; b) Org. Lett., 2020, 13, 4974-4978
[27] J. Am. Chem. Soc., 2020, 142, 8036–8043
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号