Science:三氟甲基连续可控脱氟官能团化
含氟有机化合物由于具有独特的性质如碱性、亲脂性和抗氧化性以及高度的物理和化学稳定性等而被广泛应用于生命科学和材料科学等领域。有机氟化物的高效制备一直以来都是合成化学领域的研究重点。目前,主要通过两种方式来合成含有单氟或双氟的有机化合物:第一种是有机化合物的氟化或氟烷基化反应,目前已经有许多种氟化和氟烷基化试剂被发展出来,上海有机所的中科院有机氟化学重点实验室在这方面做出了突出贡献;第二种是对三氟甲基进行选择性C-F键活化,目前报道的大多数方法只能选择性切断一个碳-氟键,产生双氟烷基正离子或者负离子中间体,而如何通过控制反应条件,可控切断一个和两个碳-氟键,选择性生成双氟和单氟烷基自由基中间体,是尚未解决的难题,其挑战性在于碳-氟键的键能随着脱氟反应的进行而逐渐减弱,当第一个碳-氟键断裂后,第二个和第三个碳-氟键更容易被活化,从而导致脱氟的过程难以控制。
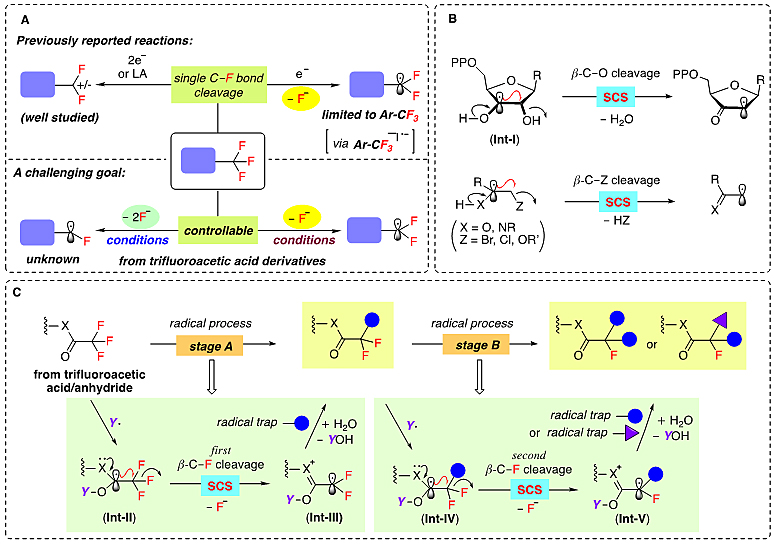
图1. 三氟甲基C-F键活化的策略。图片来源:Science
针对这一挑战,中国科学技术大学汪义丰教授(点击查看介绍)团队从spin-center shift (SCS)机制获得启发,发展了一种三氟甲基逐级可控脱氟官能团化的新策略。SCS是生物合成DNA 过程中的一个重要步骤,核糖核苷酸二膦酸酯在RNR (class I-III)的作用下,发生β-C-O键异裂并伴随1,2-自由基中心转移和一个水分子离去,生成脱氧核糖核酸二膦酸酯。该策略在合成化学中也有一些应用,主要涉及C-O、C-Br和C-Cl的断裂(图1B)。在本工作中,汪义丰教授团队利用SCS过程,实现了C-F键断裂,并发展了三氟乙酸衍生物的分步可控脱氟官能团化反应,合成了结构多样的双氟和单氟有机化合物。相关工作发表在Science 杂志上。
作者设计了两步连续且相互独立的过程来实现双氟和单氟化合物的构建:在stage A中,路易斯碱-硼自由基进攻羰基氧原子,随后发生SCS过程实现第一个C-F键的断裂,产生双氟甲基自由基,然后自由基捕获剂作用,生成双氟产物;在stage B中,硼自由基继续与双氟产物发生反应,再次引发SCS过程断裂第二个C-F键,产生单氟烷基自由基,接着发生官能团化反应生成单氟产物(图1C)。
作者以三氟乙酰胺1a作为模板底物,首先研究了连续可控的脱氟还原反应。经过条件筛选和优化,发现用1.5 equiv的4-二甲氨基吡啶硼烷络合物(DMAP-BH3)为硼自由基前体,1.2 equiv二水合磷酸二氢钠(NaH2PO4•2H2O)为添加剂,0.2 equiv苯硫酚(PhSH)为极性反转催化剂,0.2 equiv二叔丁氧基叠氮(TBHN)为自由基引发剂,乙腈为溶剂(0.1 M),60 °C条件下反应(Method-1),可以以优秀的化学选择性得到脱单氟还原产物2a。增加DMAP-BH3的量至3 equiv,同时把碱换成2.4 equiv 的Na2HPO4•12H2O,溶剂换成1,4-二氧六环(Method-2),得到单一的脱双氟的还原产物3a。在两个反应条件下,没有观测到脱三氟还原的产物。进一步研究表明,两个反应都具有广泛的官能团容忍性和适用范围。五氟丙酰胺(1o to 1s)也可以进行选择性脱氟氢化反应,而且只有羰基α-位的碳-氟键参与反应。三氟乙酸酯也可以进行脱氟氢化反应,但是三氟乙酸酯不稳定,很容易水解成醇,因此只能以中等收率得到双氟乙酸酯产物(2u)(图2)。
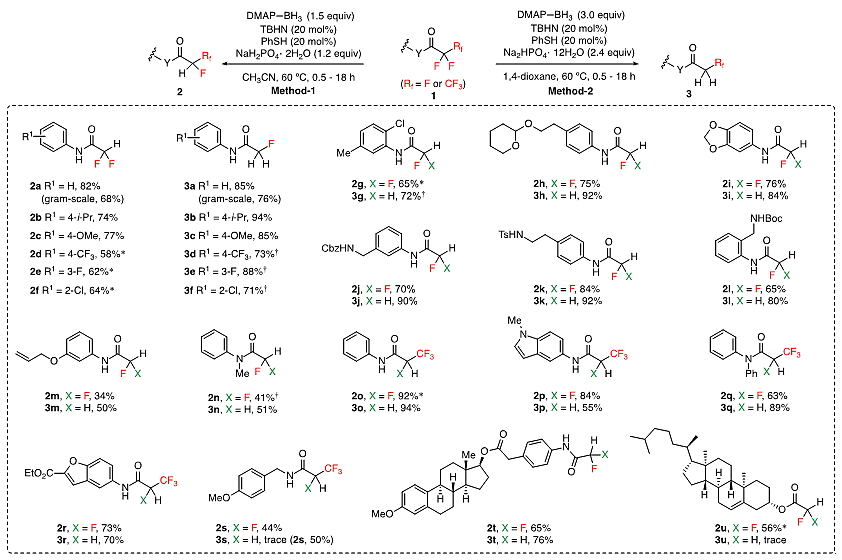
图2. 选择性脱氟氢化底物拓展。图片来源:Science
作者发现,将烯烃用作自由基捕获剂,可以得到双氟甲基自由基中间体和烯烃偶联的产物。用二叔丁基过氧化物(DTBP)作为引发剂,在120 ℃条件下,偶联效率最高。带有各种取代基的苯乙烯(4a to 4i)、乙烯基醚(4j to 4m)以及非活化烯烃(4n to 4p)都能顺利参与反应。各种取代的三氟乙酰胺(5q to 5z)都能与苯乙烯反应得到较好的收率。三氟乙酸酯也能与烯烃偶联得到中等收率的偶联产物(5ab to 5ag)。该方法可以应用于药物分子的改造和天然产物的修饰,如向抗癌药伏立诺他羰基α-位引入两个氟原子,以及向天然产物骨架上引入双氟取代基等(图3)。
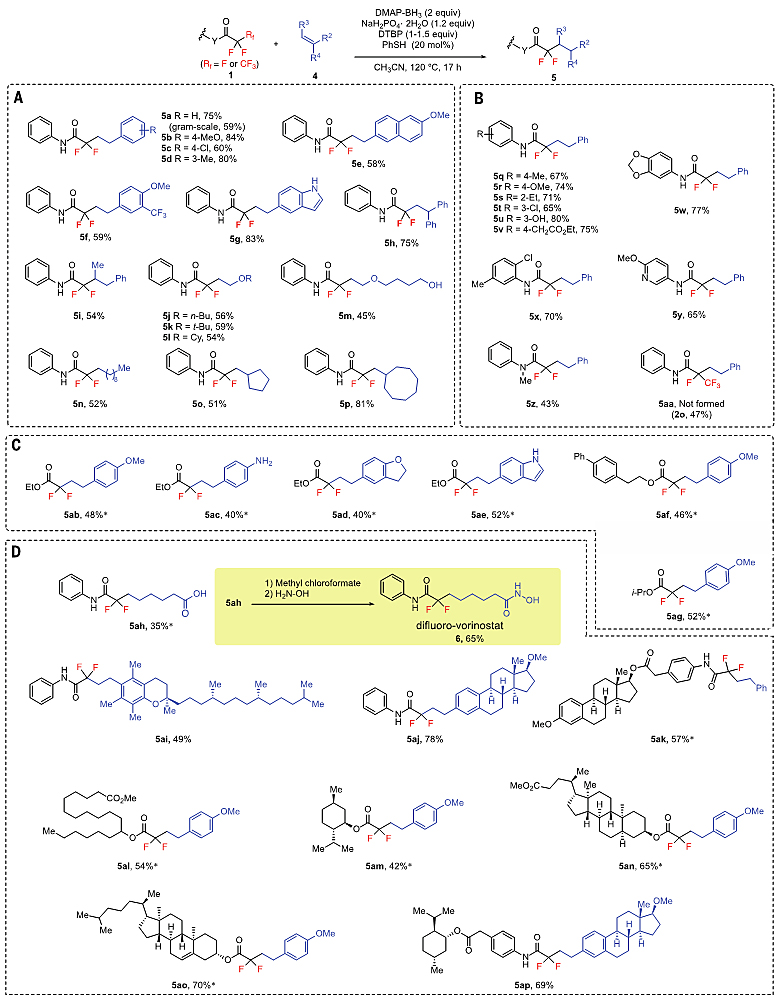
图3. 选择性脱氟偶联底物拓展。图片来源:Science
作者进一步发现,第一次C-F键活化得到的双氟产物还可以再发生一次C-F键断裂,生成各种单氟产物(图4)。对反应条件做适当优化,双氟乙酰胺就可以较好的收率与各种烯烃偶联(7a to 7m)。三氟甲基选择性脱氟偶联得到的烷基化产物也可以再次发生脱氟偶联反应,从而引入另一个不同的烷基取代基,这类产物很难用已有的方法构建。
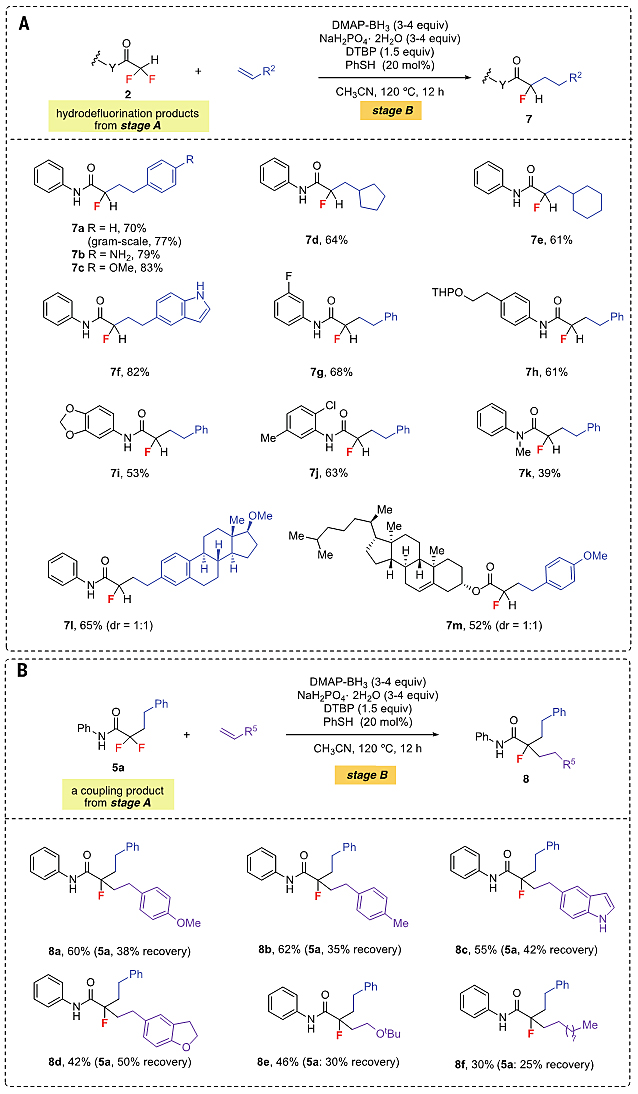
图4. 双氟产物选择性脱氟偶联底物拓展。图片来源:Science
本工作中得到的各种含氟化合物,可以通过简单的转化,进一步得到各种类型的含氟化合物。例如,硼烷可以还原各种双氟或单氟酰胺产物制备对应的胺类,双氟酯类产物可以通过经典的反应转化为相应的醇类、胺类和酮等(图5)。
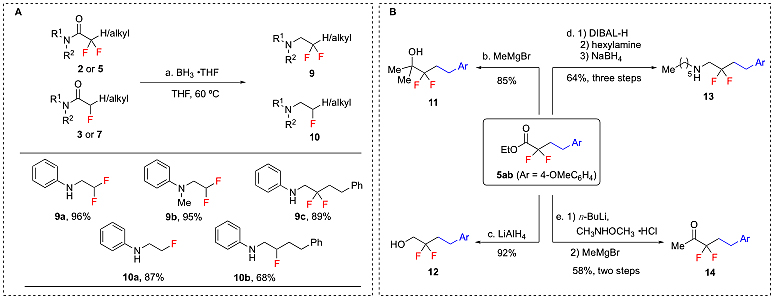
图5. 产物的转化。图片来源:Science
为了弄清楚脱氟反应的机理,作者进行了一系列的实验探究和理论计算(图6)。首先,当反应体系不加入自由基引发剂时,没有任何产物生成,这说明反应很可能经历了一个自由基历程。接下来,他们设计了两个自由基钟实验(图6 A)。在标准的反应条件下,用带有三元环和四元环的烯烃15和17做捕获试剂,分别得到了三元环和四元环开环的产物16和18,这充分说明反应体系内生成了双氟甲基自由基中间体Int-1。作者猜想在自由基引发剂的作用下,产生的硼自由基加成到羰基氧原子上生成Int-2,然后发生自旋中心转移过程断裂C-F键生成Int-3(图6B)。作者设计了一个带有自由基钟的含氟硫代酰胺底物,在标准反应条件下,得到了脱氟和开环的产物,从实验上验证了该机理的可能性(见SI fig.S4)。
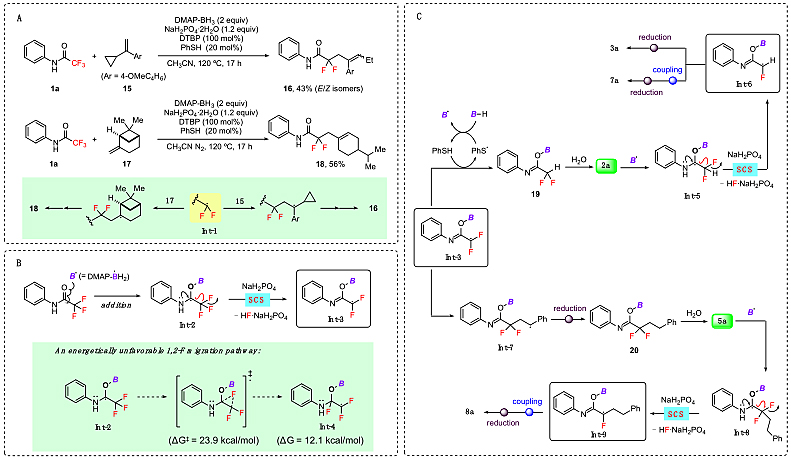
图6. 反应机理的研究和可能的机理。图片来源:Science
基于以上结果,作者提出了反应的可能机理(图6C)。硼自由基加成到三氟乙酰基化合物碳氧双键的氧原子上,得到中间体Int-2,然后在二水合磷酸二氢钠的协助下发生SCS,脱去氟离子,同时得到双氟甲基自由基中间体Int-3。中间体Int-3可以苯硫酚攫氢,得到双氟产物2a。当烯烃存在时,Int-3优先加成的烯烃的碳碳双键上,生成中间体自由基Int-7,然后被还原生成偶联双氟产物5a。双氟产物2a和5a可以继续与硼自由基反应,再发生一次SCS过程断裂第二个C-F键,产生单氟烷基自由基中间体。该中间体可以直接被还原成单氟产物3a,或者被烯烃捕获得到偶联产物7a或8a。
为了对反应机理有更深刻的认识,他们通过DFT理论计算对反应历程进行了深入研究。图7A展示了在不加入添加剂情况下的脱单氟过程。势能图显示第一步硼自由基对碳氧双键加成反应是一个很容易的步骤,然后经历过渡态TS-II-1a发生SCS。计算结果表明,在该SCS过程中,钠离子能帮助氟离子的离去,降低活化能。作者通过实验证明,加入NaH2PO4确实不仅能提高产物的收率,也大大加快了反应的速率。对于N-甲基三氟乙酰胺1n和三氟乙酸乙酯1dd,脱氟反应只有在碱金属离子(如钠盐、锂盐)的存在下才能发生,说明碱金属离子对脱氟过程起到了至关重要的作用。计算结果也表明,不加入钠离子,它们的SCS脱氟是严重吸能的过程,反应不能进行;当加入钠离子后,反应具有合理的活化能,能够顺利发生。
他们还研究了中间体Int-2发生SCS时,电荷转移和电子自旋转移的过程(图7C)。对于中间体TS-II-1a,可以发现即将离去的氟离子带有明显的负电荷(-0.73)和相对较低的自旋密度(0.07),这说明C-F键的断裂是异裂过程。自旋密度分析结果显示,在中间体Int-2上,单电子大部分位于羰基碳原子上(0.53),在SCS过程中,单电子逐渐转移到直接连氟的碳原子以及氮原子上,而在最终生成的Int-3上,单电子主要分布于连氟碳原子(0.47)和氮原子上(0.26)。
DFT计算表明,三氟乙酰胺1a的SCS过程相比二氟乙酰胺2a在动力学和热力学上更为有利,而一氟乙酰胺3a断裂最后一个C-F键比2a还要容易,这种趋势与1a→2a→3a C-F键的键解离能逐步降低是一致的(图7D)。但是,实验结果发现1a→2a→3a,脱氟反应变得越来越不利,单氟乙酰胺3a几乎不能再继续反应,这与C-F键断裂的难易趋势相反。进一步研究发现,反应的选择性可能取决于硼自由基的加成步骤。从1a→2a→3a,随着氟原子个数的减少,其LUMO能量越来越高,导致硼自由基/底物之间的SOMO/LUMO能级差越来越高(图7E,从1a到3a能级差分别为4.03 eV、4.14 eV、4.45 eV),进而使得加成反应越来越不利,反应越来越难以进行,因此保障了连续脱氟过程的可控性。
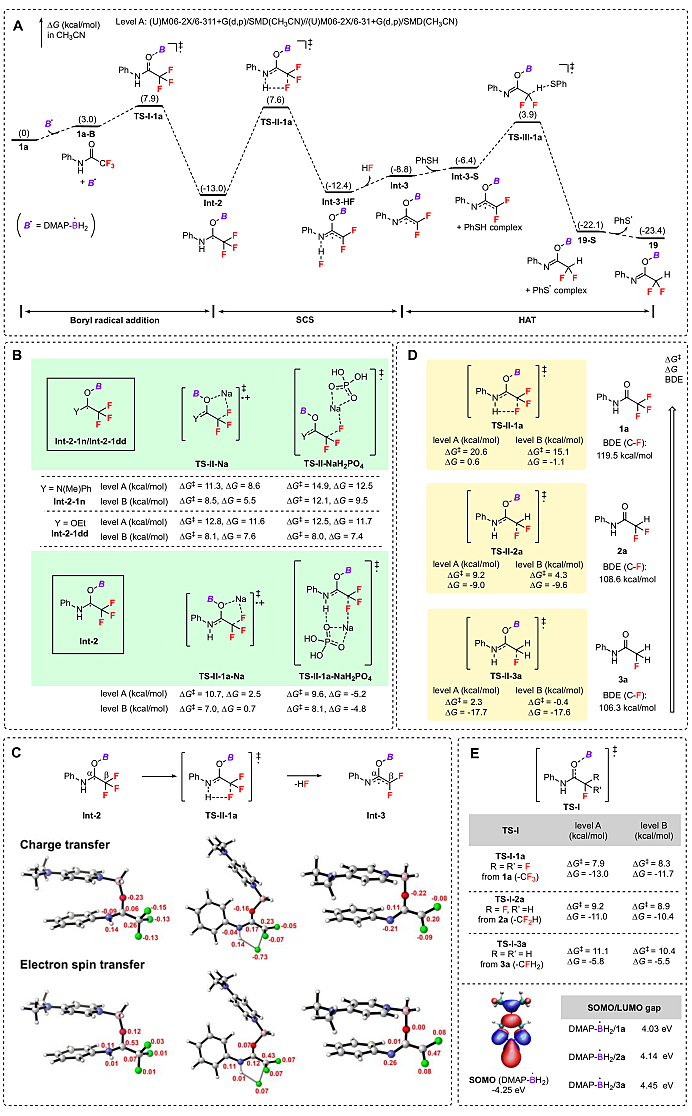
图7. DFT理论计算。图片来源:Science
总结
汪义丰教授课题组报道了4-二甲氨基吡啶-硼自由基促进的三氟甲基逐级可控脱氟官能团化反应。该反应有效地解决了三氟甲基脱氟的选择性问题,通过条件控制,可以选择性的断裂一个或两个C-F键,生成相应的双氟甲基自由基或单氟甲基自由基,再经过还原或自由基加成,得到相应的双氟或单氟产物。通过对机理的详细探究,他们发现C-F键的断裂经历了自旋中心转移(Spin-center shift)过程,反应的化学选择性通过自由基加成步骤的难易程度控制。本反应条件温和,选择性好,原料三氟乙酸衍生物制备简单,廉价易得,为规模合成单氟或双氟化合物提供了一种理想的途径。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Sequential C–F bond functionalizations of trifluoroacetamides and acetates via spin-center shifts
You-Jie Yu, Feng-Lian Zhang, Tian-Yu Peng, Chang-Ling Wang, Jie Cheng, Chen Chen, Kendall N. Houk, Yi-Feng Wang
Science, 2021, 371, 1232-1240, DOI: 10.1126/science.abg0781
导师介绍
汪义丰
https://www.x-mol.com/groups/yifeng_wang
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
氯化亚铁催化三氟甲基烯烃硼化-脱氟反应合成偕二氟烯丙基硼酸酯 2017-07-03
-
可见光诱导多氟芳烃、偕二氟烯烃、三氟甲基取代烯烃的选择性脱氟硼化反应 2020-02-09
-
单电子氧化产生氮杂卡宾-硼自由基及其新转化研究 2020-06-01
-
CCS Chemistry | 新型自由基催化环化异构化反应 2021-02-03



































 京公网安备 11010802027423号
京公网安备 11010802027423号