“活体自组装”策略:实时、定量检测细胞自噬
“活体自组装(In vivo self-assembly)”是指响应性分子或纳米材料在复杂的生理环境(细胞、组织和活体)下原位可控构筑高级有序组装体的方法。该方法有望实现生物活性成分(例如:药物、核酸、蛋白质等)在病灶部位靶向、富集、滞留,并且可显著增强药效及降低毒副作用。基于该策略,中国科学院国家纳米科学中心的研究人员发现了一系列有趣的生物效应,例如:组装/聚集诱导滞留效应(Assembly/Aggregation Induced Retention, AIR)效应(Adv. Mater., 2015, 27, 6125-6130),AIR效应可以有效的优化生物活性分子在体的生物分布,增加药物的肿瘤渗透性并改善药动和药代行为。为发展新型高效、低毒的生物材料提供新的思路。
细胞自噬是真核生物非常保守的一种生物降解过程。在该过程中一些长周期或者错误折叠的蛋白及受损伤的细胞器被双层膜结构的自噬小泡包裹后,送入溶酶体进行降解以实现细胞本身的代谢需要和某些细胞器的更新。细胞自噬参与了众多生理和病理过程,比如细胞死亡、病原体清除、抗原呈递等,其功能异常伴随着衰老、神经退行性疾病和癌症等疾病。对细胞自噬过程的实时、定量检测,对研究细胞自噬发生机制与疾病的关系及发展细胞自噬介导的治疗方法都具有极其重要的意义。目前常规的自噬检测技术主要包括:透射电子显微镜、蛋白质免疫印迹和GFP-LC3/ATG8等方法,主要检测自噬相关的结构和蛋白来片面的判断细胞自噬活性,而且这些方法样品前处理过程繁琐、技术要求高、耗费时间长,且在活体应用上受到极大的限制。
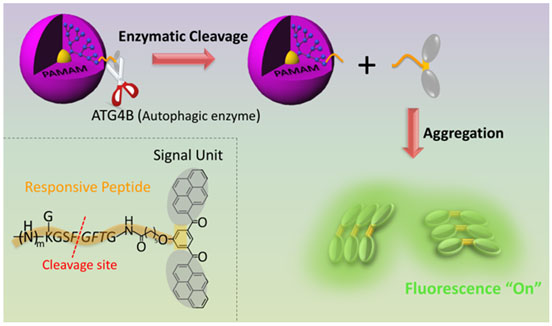
基于“活体自组装”策略设计的纳米探针用于实时、定量的检测细胞自噬
基于“活体自组装”策略,研究人员设计了以具有聚集诱导发光效应(AIE)的双芘为信号分子,利用酶响应的多肽将信号分子与树枝状高分子偶联形成纳米探针。树枝状分子的位阻效应保证信号分子不聚集,保证了信号分子在正常细胞中处于荧光淬灭的单体状态,只有当细胞处于自噬激活状态时,纳米探针被自噬酶特异性剪切,导致信号分子从树枝状分子上解离并自组装/聚集为新的纳米结构,表现出显著提升的荧光信号。通过对荧光信号强度的检测可以实时、定量地分析细胞自噬行为。值得关注的是该探针应用于多种活细胞及模式生物(斑马鱼)上,其检测准确性和有效性也同时得到了其他传统方法的验证。
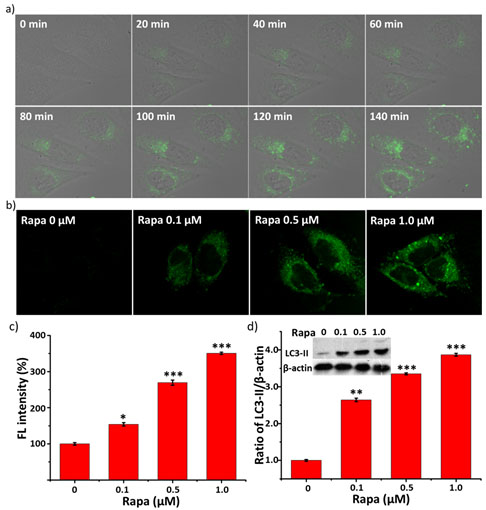
纳米探针实时、定量的检测细胞自噬过程
相关成果发表在ACS Nano上,第一作者为林耀新,王浩研究员(点击查看介绍)和王磊研究员(点击查看介绍)为本文共同通讯作者。该工作得到了国家自然科学基金、国家自然科学基金创新研究群体、中国科学院国际合作局对外合作重点项目基金的支持。
该论文作者为:Yao-Xin Lin, Sheng-Lin Qiao, Yi Wang, Ruo-Xin Zhang, Hong-Wei An, Yang Ma, R. P. Yeshan J. Rajapaksha, Zeng-Ying Qiao, Lei Wang,* and Hao Wang*
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

An in Situ Intracellular Self-Assembly Strategy for Quantitatively and Temporally Monitoring Autophagy
ACS Nano, 2017, 11, 1826–1839, DOI: 10.1021/acsnano.6b07843
导师介绍
王浩
http://www.x-mol.com/university/faculty/23181
王磊
http://www.x-mol.com/university/faculty/23225
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
老树开新花:分子自组装遇到二维材料 2017-02-07
-
聚噻吩和金纳米棒在溶液中的多级自组装 2016-09-24
-
《Nature Chem.》:自组装纳米球成为高效催化剂 2016-01-18
-
Flowerlike BiOCl nanospheres fabricated by an in situ self-assembly strategy for efficiently enhancing photocatalysisJournal of Colloid and Interface Science (IF 9.4) Pub Date : 2021-09-04 ,DOI:10.1016/j.jcis.2021.09.002Cheng Liu, Yahang Ren, Zhiwen Wang, Yingzhang Shi, Binbin Guo, Yan Yu, Ling Wu


































 京公网安备 11010802027423号
京公网安备 11010802027423号