基于链式反应的自放大肿瘤靶向递送新策略
主动靶向肿瘤的药物递送在癌症治疗中具有巨大的潜力,其可以提高治疗药物的选择性,减少药物副作用,提高治疗效果,从而引起人们的广泛关注。主动靶向策略根据肿瘤组织本身相对于正常组织高表达的受体或靶标情况,针对性设计修饰有相应靶头(例如,生物小分子、多糖、多肽、抗体或适配体等)的纳米药物来进行肿瘤靶向递送。然而,传统的主动靶向纳米药物静脉注射给药后主要分布在肿瘤血管周围,并不能够进一步渗透到远离肿瘤血管的区域,导致绝大部分肿瘤细胞的受体/靶标没有与纳米药物靶头接触的机会。因此,选择性地增加肿瘤中纳米药物可接触的受体/靶标的数量是提高主动靶向纳米药物递送效率的关键。
基于此,中国科学院长春应用化学研究所陈学思(点击查看介绍)、汤朝晖(点击查看介绍)团队提出了新的主动靶向策略——链式自放大肿瘤靶向。基于链式反应如聚合酶链反应和核链式反应等这一类具有高效放大性的反应机理设计表面修饰有凝血靶头A15的自放大肿瘤靶向血管阻断剂纳米药物(A15-PLG-CA4)(图1)。其经尾静脉注射进入体内后,由于血管阻断剂纳米药物的肿瘤靶向性而富集在肿瘤部位,并在肿瘤部位释放CA4(链式反应引发步);CA4 作为一种血管阻断剂,选择性地破坏已存在的肿瘤血管,导致瘤内出血(第一步);并进一步使FXIII被激活为FXIIIa,增加肿瘤内部凝血靶标(第二步);进而招募更多的A15-PLG-CA4在肿瘤内富集(第三步);在肿瘤部位富集的A15-PLG-CA4 释放更多的CA4(第四步),CA4继续选择性地破坏肿瘤血管,导致瘤内出血从而继续进行下一个循环,如此周而复始,以上四个步骤组合起来形成一个高效的“链式反应”(图2)。

图1. 自放大肿瘤靶向纳米药物A15-PLG-CA4的构建及其表征

图2. 基于链式反应的自放大肿瘤靶向纳米药物递送平台的示意图
通过这种策略,富集在肿瘤部位的A15-PLG-CA4 能够激活更多的FXIIIa(靶标),催化A15 多肽进行谷氨酰胺转移反应,使更多的A15-PLG-CA4 与凝血块结合从而靶向富集在肿瘤部位。另外,由于FXIIIa 可容易地被血液循环系统中的纳米药物接触到,因此自放大肿瘤靶向纳米药物A15-PLG-CA4 可以达到选择性增加肿瘤中纳米药物可接触的靶标数量的目的,从而有效地提高主动靶向递送效率。
实验证明,利用A15-PLG-CA4对C26荷瘤小鼠进行治疗,其确实能够启动由瘤内出血、靶标FXIIIa增加、与血凝块结合和瘤内释放CA4四步组成的链式反应(图3)。作者观察到治疗8 h后,瘤内FXIIIa 活性增加到0 h的4.1倍,并且在24 h时,A15-PLG-CA4 治疗后FXIIIa 的活性是非靶向对照组(A15'-PLG-CA4 )的3.0倍,表明A15-PLG-CA4作用后,瘤内凝血靶标FXIIIa 的活性显著增强。同时检测到A15-PLG-CA4治疗24 h后, 瘤内总的CA4浓度是对照组的2.9倍;并且瘤内游离的CA4浓度增加到对照组的3.2倍,实现了A15-PLG-CA4的肿瘤靶向释放。

图3. 对链式反应的每一步进行体内外验证
由于A15-PLG-CA4具有显著的肿瘤靶向能力,在C26大肿瘤模型(≈500 mm3)表现出显著的抗肿瘤疗效,给药后第8天,A15-PLG-CA4 治疗组的肿瘤抑制率为86.2%,远高于A15'-PLG-CA4对照组的肿瘤抑制率(63.1%),并且生存期显著延长(图4)。以上结果表明,A15-PLG-CA4能够实现选择性增加肿瘤中纳米药物可接触的靶标数量的目的,从而有效地提高了主动靶向递送效率,增强了血管阻断剂纳米药物的抗肿瘤疗效。
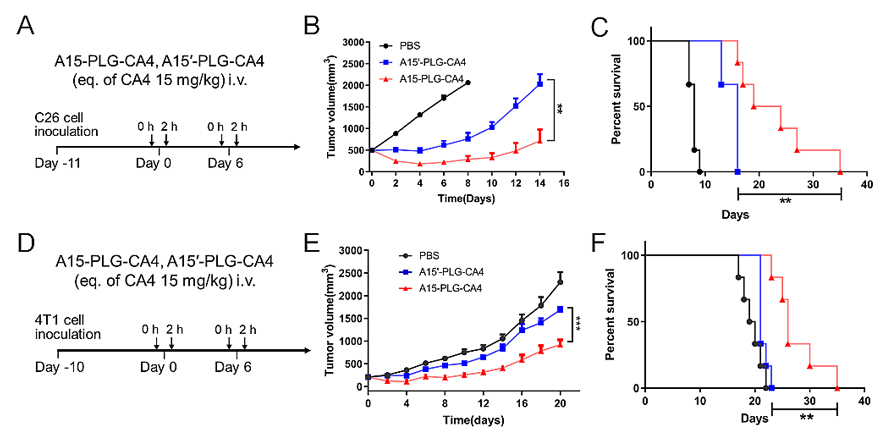
图4. A15-PLG-CA4对C26与4T1荷瘤的BALB/c小鼠的体内抗肿瘤功效评价。
这种基于链式反应的自放大肿瘤靶向递送策略对于实现高效的肿瘤靶向递送具有很大的发展潜力。接下来作者以链式自放大肿瘤靶向纳米药物作为靶向递送平台,构建了链式自放大肿瘤靶向共载纳米药物A15-PLG-CA4/BLZ945,以期望将CA4与BLZ945这两种具有协同抗肿瘤疗效的药物高效地靶向递送到肿瘤部位。利用A15-PLG-CA4/BLZ945对C26荷瘤小鼠进行治疗,观察到A15-PLG-CA4/BLZ945 组治疗24 h 后瘤内CA4 和BLZ945 的总浓度分别是非靶向共载对照组(A15'-PLG-CA4/BLZ945)的3.5 倍和3.8 倍;瘤内游离的CA4的浓度是对照组的3.7倍,结果表明自放大肿瘤靶向共载纳米药物具有较强的肿瘤靶向能力,能够实现药物的高效肿瘤靶向递送。在C26大肿瘤模型进行抗肿瘤治疗,结果显示即使进行一次给药,A15-PLG-CA4/BLZ945表现出显著的抗肿瘤疗效(图5)。综上,作者基于链式自放大肿瘤靶向策略构建了一个具有发展潜力的药物递送平台,肿瘤靶向递送效率显著提高,可以将更多的小分子药物高效递送到肿瘤部位,提高抗肿瘤疗效。
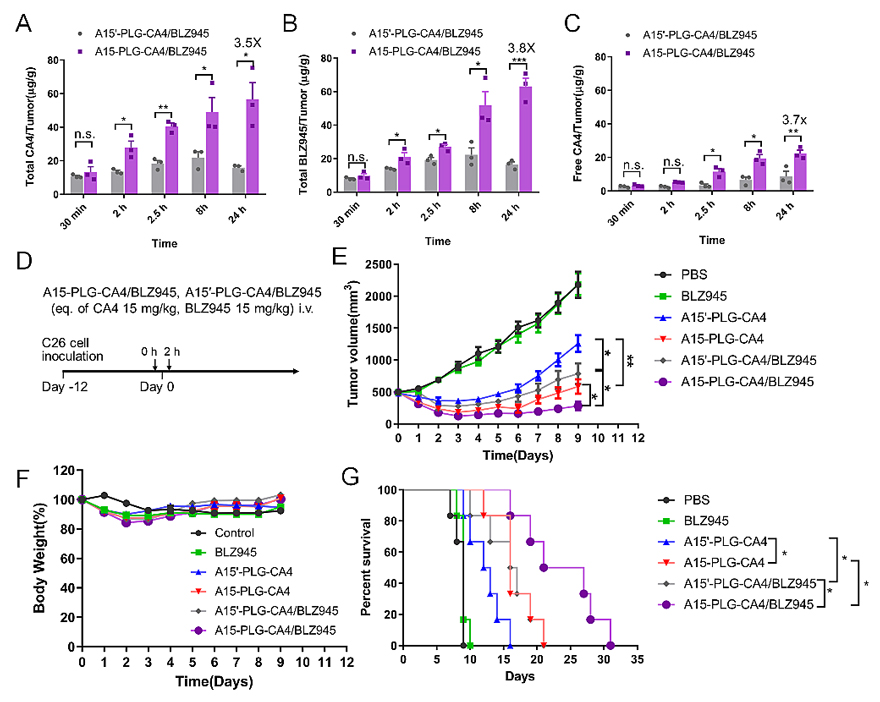
图5. 利用链式自放大靶向纳米药物作为递送平台实现BLZ945的选择性肿瘤靶向递送
以上研究结果近期发表在Advanced Materials 上,中国科学院长春应用化学研究所博士生王月为论文的第一作者,汤朝晖研究员为论文的通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Self‐Amplifying Nanotherapeutic Drugs Homing to Tumors in a Manner of Chain Reaction
Yue Wang, Na Shen, Ying Wang, Yu Zhang, Zhaohui Tang, Xuesi Chen
Adv. Mater., 2021, DOI: 10.1002/adma.202002094
导师介绍
陈学思
https://www.x-mol.com/university/faculty/15824
汤朝晖
https://www.x-mol.com/university/faculty/15845
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号