ACS Applied Bio Materials 封面 ǀ 基于细化的皮肤分层模型实现对伤口愈合的电刺激优化
英文原题: Toward Controlled Electrical Stimulation for Wound Healing Based on a Precision Layered Skin Model

通讯作者: Xiaozhi Wang (汪小知), Key Lab. of Advanced Micro/Nano Electronic Devices & Smart Systems of Zhejiang, College of ISEE and Hangzhou Global Scientific and Technological Innovation Center, Zhejiang University, Hangzhou 310027, China; Wei-Qiang Tan (谈伟强), Department of Plastic Surgery, Sir Run Run Shaw Hospital, Zhejiang University School of Medicine, Hangzhou 310016, Zhejiang Province, PR China
作者: Menglu Li (李梦露), Xiaofeng Wang (王晓凤), Pandey Rajagopalan, Liang Zhang (张亮), Shijie Zhan (詹士杰), Shuyi Huang (黄淑毅), Wei Li (李威), Xiangyu Zeng (曾翔宇), Qikai Ye (叶启开), Yulu Liu (刘雨露), Kai Zhong (钟凯), Jong Min Kim, Jikui Luo (骆季奎), Shurong Dong (董树荣), Rongcheng Gu (顾容铖), Xiaozhi Wang (汪小知)*, Wei-Qiang Tan (谈伟强)*
生物电在人体中发挥着重要的功能,如稳态调节、神经传导、皮肤伤口修复等。在完整的人体皮肤中,表皮中活跃的Na+/K+ ATP酶泵会产生并维持20-50mV的经皮电位差。当皮肤受损时,上皮损伤使伤口部位短路,降低了伤口表面的电位,从而形成指向伤口中心的内源性侧方电场。该电场已被证实可以引导细胞迁移,并刺激生长因子的分泌,促进伤口愈合。然而,在糖尿病慢性创面中,该电场往往较为微弱,甚至趋于衰竭,从而延长了炎症阶段的时长。通过外加电刺激对该电场进行补充已被证实是一个有效的促进糖尿病慢性创面愈合的手段。引入外部电刺激能够同时刺激神经通路和调整炎症反应,也可能会与其他共存的方向性信号叠加,以引导角质细胞的迁移,这表明电刺激在伤口修复中的作用远比以前推测的更重要和关键。
然而,该疗法的机理和选择标准仍不清楚,目前对电刺激的参数选择往往为经验性的,粗放的,大致分为高低压的恒压直流(DC),单相脉冲(SP),双相脉冲刺激(BP)。这导致电刺激参数优化效率低下,效果不佳。因此,探究电刺激疗法的机理,为电刺激参数选择提供理论依据,对于提高电刺激治疗糖尿病创面的效率极其重要。
针对电刺激参数优选理论的建立问题,浙江大学信息与电子工程学院微电子所的汪小知博士与浙江大学医学院的谈伟强博士等人合作开展了实验研究。在本研究中,该团队整合了生物电化学和固态电路模型,首先获取了分层大鼠皮肤的阻抗谱,发现了谐振现象,在此基础上建立了RCL分层皮肤电路模型。根据皮肤主要电化学反应及电路模型仿真得到的弛豫时间分析,确定了优化的静息时间(>5.35 ms)及相应的频率和占空比。通过考虑有效的直流分量和注入电荷总量,建立了电刺激促进伤口愈合的参数选择窗口。
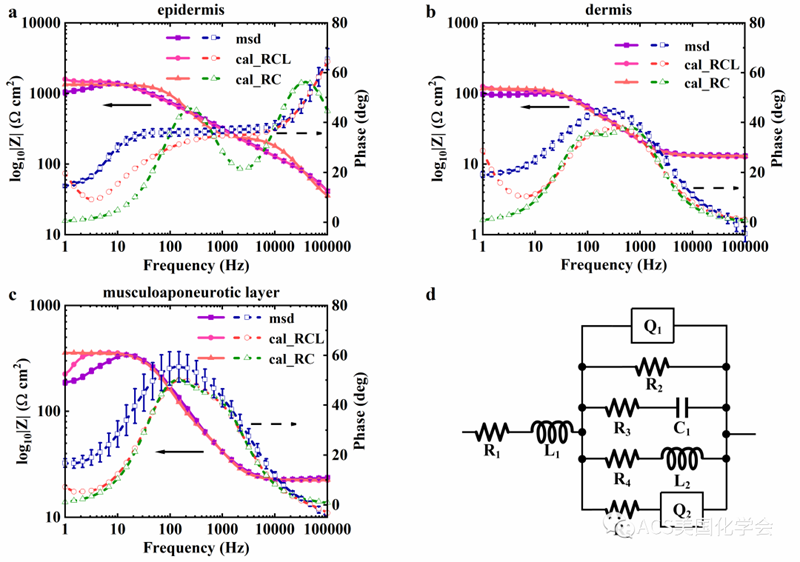
图1. 使用本文提出的RCL模型(d)和经典的Cole-Cole RC模型对表皮层(a)、真皮层(b)和肌层(c)的EIS拟合结果。RCL模型的拟合结果优于RC模型,尤其是表皮层。
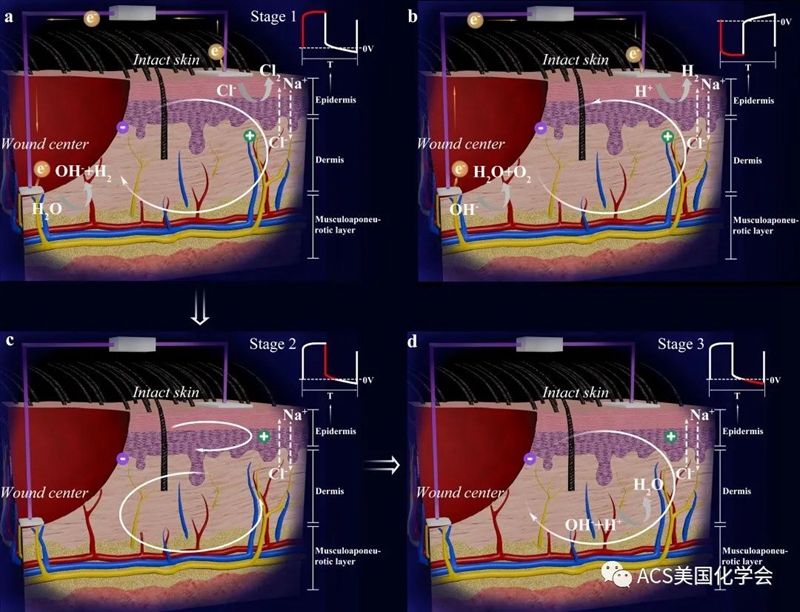
图2. 脉冲电压作用于伤口时的离子传输示意图。(a)、(c)、(d)为正向脉冲刺激时的主要电场分布和电化学反应,(b)为反向脉冲刺激时的相对反应。
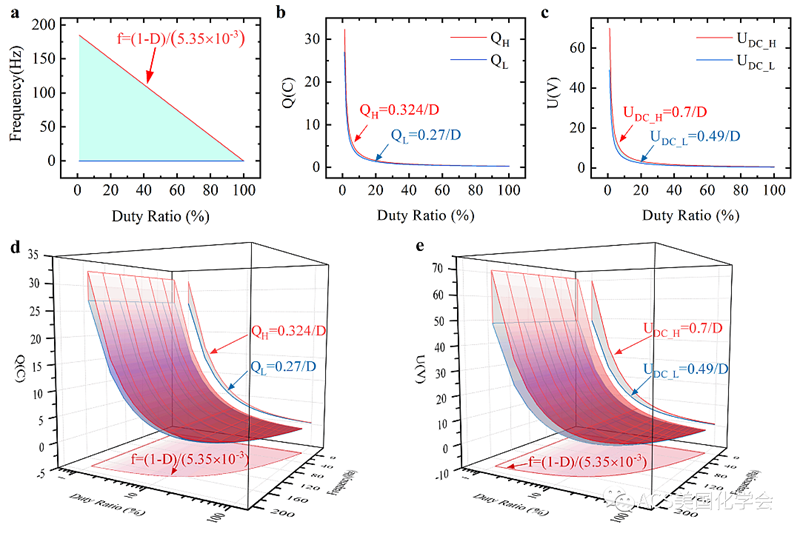
图3. 基于电荷、直流分量和仿真结果的二维(a-c)和三维(d,e)刺激参数选择窗口。窗口对频率、占空比和电压或电荷的优选范围提出了建议。
此外,本研究设置了表面电极组(S组)和微创电极组(P组)进行了大鼠体内实验以验证该优化方法并进一步优化窗口边界。研究发现,在高低恒压、单相、双相刺激作用中,参数落在窗口中的单相高压脉冲的伤口修复效果最优,9天左右促愈合速率达到最高,超过10%,总促愈合天数达到3天左右,远高于其余组。此外,与表面电极相比,微创电极在同强度电刺激下更易引起刺激部位的化学烧伤。因此,相比于微创电极,表面电极作为电刺激的作用媒介更安全。
表1. 体内实验电刺激参数。
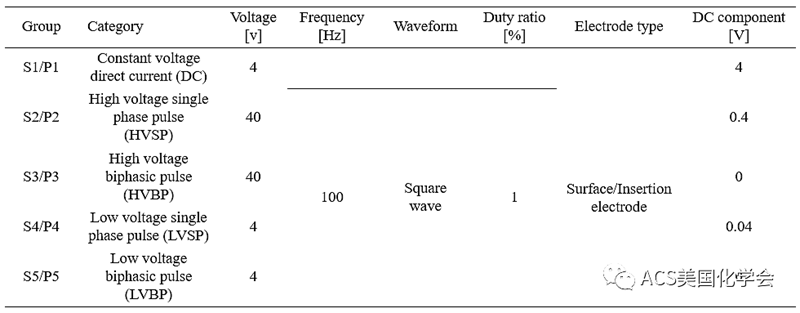
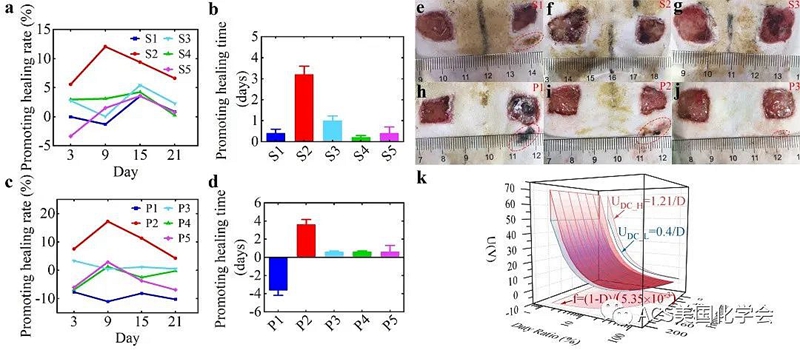
图4. 体内实验结果,包括S组(a、b)和P组(c、d)的愈合率和愈合时间。HVSP的效果较好。S2(f)和S3(g)的伤口状态正常,而S1(e)的伤口周围有明显的烧伤,说明4V、1h直流电刺激超过了伤口愈合的阈值电压。P1(h)、P2(i)、P3(j)组均有烧伤,其中P1组损伤比其他组更严重。根据该体内实验扩大边界的窗口(k)。
课题组从生物电学和电化学的角度出发,实现了皮肤的电化学及固态电路模型的整合分析,对电刺激的机理进行了详细研究,得到了频率、占空比、电压、电荷等方面的电刺激窗口,并进行了实验验证。该模型为电刺激疗法在伤口愈合方面的优化提供了普遍指导。相信类似的方法也可以应用于人类,促进慢性创面的电刺激治疗。此外,通过本工作的基础研究,可以对电刺激进行分层分析,将进一步的研究引向微观尺度,包括炎症反应、神经通路等愈合机制。
本项目得到了国家重点研发计划 (National Key R&D program of China)、国家自然科学基金 (National Natural Science Foundation of China)、浙江省重点研发项目 (Key Research and Development Project of Zhejiang)、浙江实验室 (Zhejiang Lab)、浙江省医药卫生科学基金 (Zhejiang Provincial Medical and Healthy Science Foundation of China) 的支持。
本研究的相关结果作为 (内页) 封面文章已发表于 ACS Applied Bio Materials, Volume 3, Issue 12。
扫描二维码阅读英文原文,或点此查看原文

ACS Applied Bio Materials, 2020, 3, 12, 8901-8910
Publication Date: November 16, 2020
https://doi.org/10.1021/acsabm.0c01190
Copyright © 2020 American Chemical Society

ACS Applied Bio Materials 创刊于2018年7月,仅在线出版,12期/年,已被 Web of Science,Scopus 等数据库收录,旨在为读者及作者提供生物相关功能材料的设计及其应用的突破性与原创性研究,是将材料学、工程学、生物学、医学及化学知识融合于重要的生物应用的前沿期刊。
涵盖研究领域包括生物材料、生物医用材料、生物能源、生物催化、生物电子、生物污损与防污材料、仿生材料、生物分子成像/传感、药物传递/靶向、自修复材料、抗菌/抗微生物及抗癌生物材料等。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号