CCS Chemistry | DNA去甲基化新通路:5-羧基胞嘧啶直接脱羧基
摘要:武汉大学袁必锋-冯钰锜课题组通过设计合成含有5-羧基胞嘧啶(5caC)的DNA,结合稳定同位素标记和质谱分析技术,发现DNA中的5caC 可以通过碳碳键的断裂直接脱羧基生成胞嘧啶,从而构成DNA中5-甲基胞嘧啶(5mC)去甲基化的新通路。
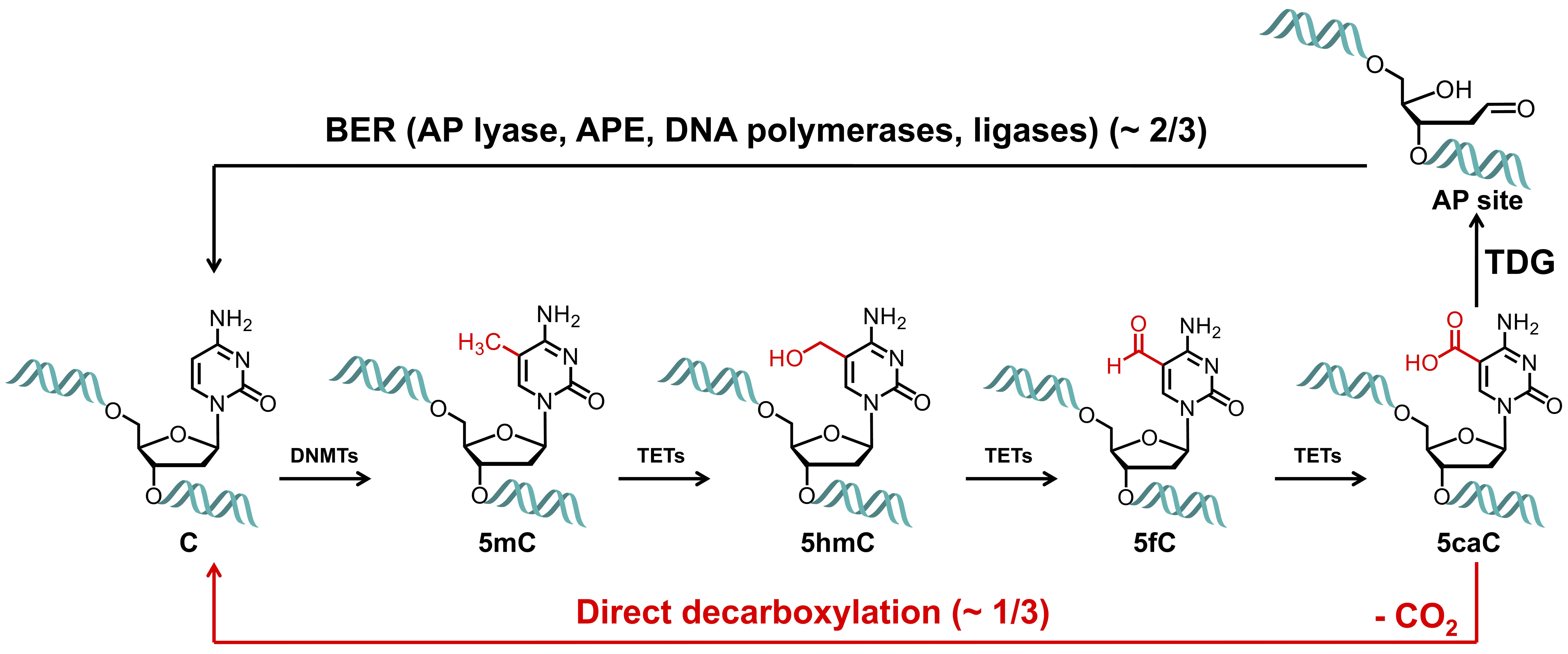
DNA的甲基化调节基因的表达和沉默,与癌症和老年痴呆等许多疾病密切相关。但是,为了保证基因在适当的发育阶段进行程序性表达,生物体内也会发生DNA去甲基化(demethylation)的现象来调节DNA甲基化程度。DNA甲基化和去甲基化的动态平衡控制着生物体内基因表达的强度。
DNA去甲基化是指5-甲基胞嘧啶(5-methylcytosine,5m C)被胞嘧啶取代。近年来研究发现动物中去甲基化的一个主要机制是:TET(ten-eleven translocation)蛋白先将5mC氧化生成5-羟甲基胞嘧啶(5hmC)、5-醛基胞嘧啶(5fC)和5-羧基胞嘧啶(5caC),随后通过TDG糖苷酶(thymine DNA glycosylase)识别并切割5fC和5caC的糖苷键,形成无碱基的AP位点,进而通过碱基切除修复(base excision repair,BER)得到未甲基化的胞嘧啶。
TDG-BER是目前哺乳动物基因组DNA中5mC去甲基化的主要机制,但并不适用于所有情形。有研究发现TDG基因敲除掉的小鼠受精卵中5mC的去甲基化过程并没有受到影响(Cell Stem Cell. 2014, 15, 447-458),暗示5mC的去甲基化可能存在着一种不依赖于TDG糖苷酶的机制。此外,在TDG糖苷酶切除5fC和5caC糖苷键的过程以及在BER修复过程中会产生DNA链的断裂等中间体,因此基于TET -BER机制的DNA去甲基化会危害基因组的稳定性和完整性。
武汉大学袁必锋-冯钰锜课题组设计合成了一条含有5caC修饰并含有酶切位点的发卡DNA(5caC-DNA),5caC-DNA链的3’末端标记生物素Biotin,5caC-DNA链上7个位置的磷酸二酯键中的氧原子用硫原子进行替换。首先将5caC-DNA与细胞裂解物进行温育,用链霉亲和素磁珠富集温育后的DNA。富集的DNA酶解为核苷酸或者寡核苷酸链后进行质谱分析,发现了5caC直接脱羧产物:硫代胞嘧啶单磷酸核苷酸(S-dCMP),以及5caC直接脱羧基产生的寡核苷酸链([M-4H]4-, m/z 1859.67),证实细胞提取物可以使5caC直接脱羧基。
作者进一步将5caC-DNA转染进入细胞,并在转染后不同时间点收获细胞。通过分析由体内富集出的DNA酶解的核苷酸或者寡核苷酸链,发现了5caC直接脱羧产物:S-dCMP,以及脱羧基寡核苷酸链([M-4H]4-, m/z 1859.67),证实5caC在体内可以发生直接脱羧基(图一)。
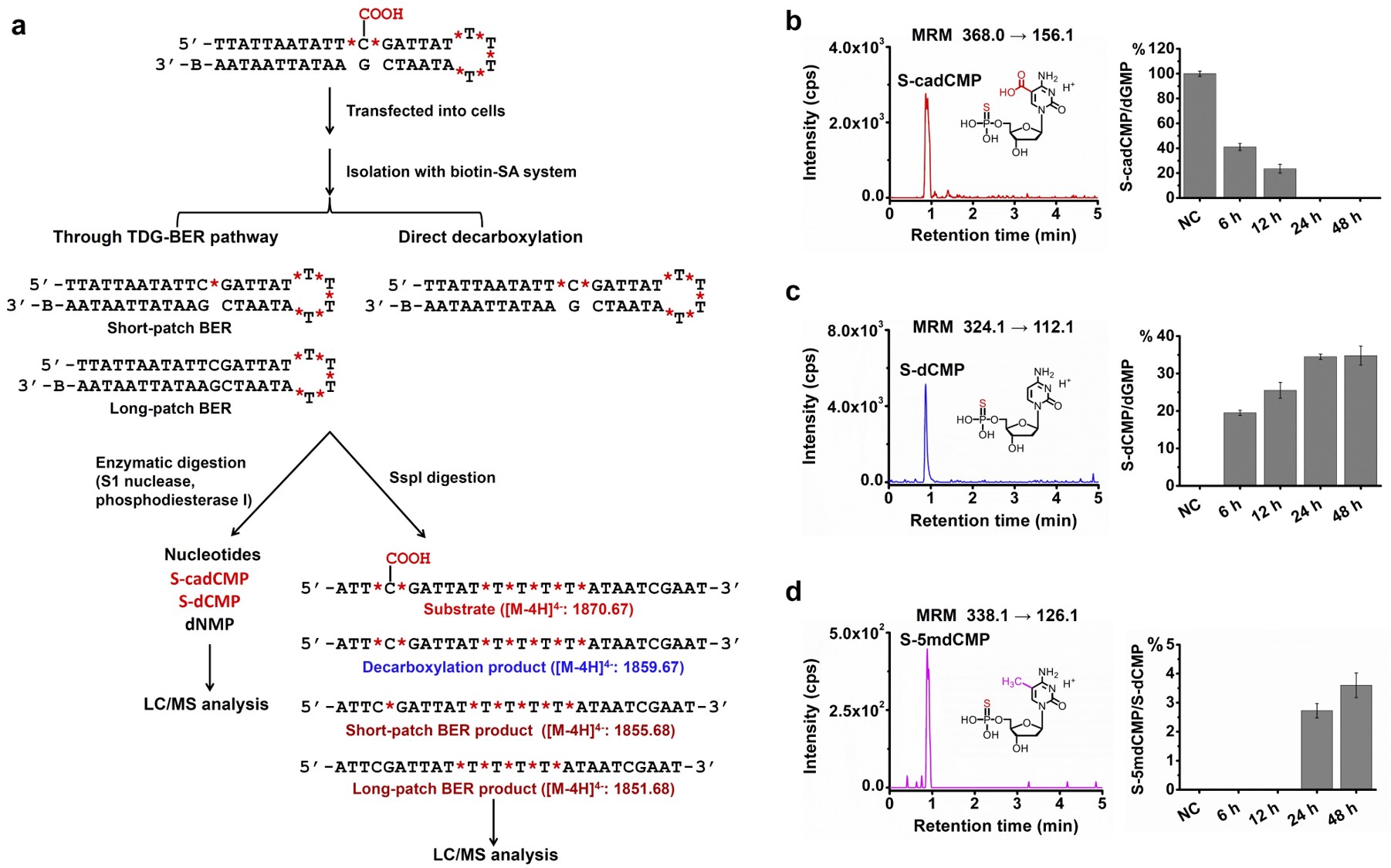
图一. 5caC内源性脱羧基。(a) 5caC内源性脱羧基实验流程图。(b) 质谱分析5caC核苷酸底物S-cadCMP。(c) 质谱分析5caC直接脱羧基核苷酸产物S-dCMP。(c) 质谱分析5caC直接脱羧基后重新甲基化的核苷酸产物S-5mdCMP。
由于细胞内存在TGD-BER通路,因此转入到细胞中的5caC-DNA也会由此通路修复为未修饰的胞嘧啶。通过酶切产生的寡核苷酸链分析可以观察到底物寡核苷酸链([M-4H]4-, m/z 1870.67),直接脱羧基产生的寡核苷酸链([M-4H]4-, m/z 1859.67),以及短修复产生的寡核苷酸链([M-4H]4-, m/z 1855.68)和长修复产生的寡核苷酸链([M-4H]4-, m/z 1851.68)(图二)。定量分析发现5caC的体内直接脱羧基、以及经过TDG-BER通路(短修复和长修复)的比例约为1/3和2/3(图二)。
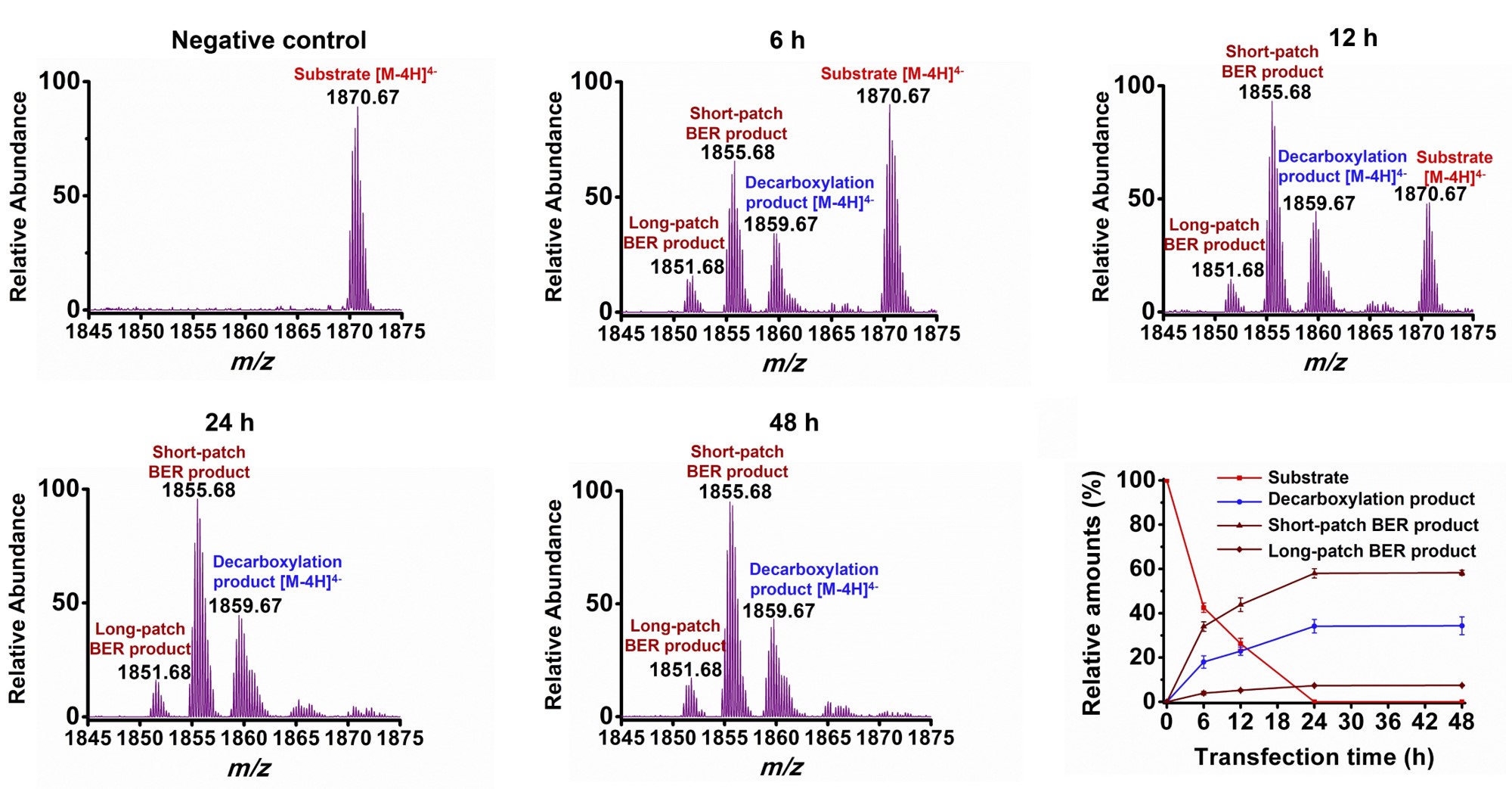
图二. 质谱分析寡核苷酸证实不同时间点5caC内源性脱羧基以及比例。
m/z 1870.67:底物寡核苷酸链;m/z 1859.67:直接脱羧基产生的寡核苷酸链;m/z 1855.68:短修复产生的寡核苷酸链;m/z 1851.68:长修复产生的寡核苷酸链。
接下来作者使用TDG糖苷酶抑制剂抑制TDG活性,以及通过siRNA敲低TDG基因、或者通过CRISPER-Cas9 敲除TDG基因,使TDG蛋白表达降低或丧失。结果发现在TDG糖苷酶活性抑制或丧失的细胞中,5caC直接脱羧基的比例增加,而TDG-BER通路比例减少,进一步证实体内存在基于5caC直接脱羧基和基于TDG-BER通路的两种DNA去甲基化机制。
随后作者通过稳定同位素代谢标记,将细胞基因组中的dC替换为15N3-dC,然后将5caC-DNA转染进入细胞。实验结果也同样发现了直接脱羧基产物S-dCMP和TDG-BER通路进行修复的产物15N3标记的胞嘧啶单磷酸核苷酸(15N3-dCMP)。通过分析酶切产生的寡核苷酸链,进一步证实5caC直接脱羧基与TDG-BER通路所占的比例分别约为1/3和2/3。
该研究工作提出的基于5caC直接脱羧基的DNA去甲基化新机制只涉及到TET蛋白氧化5mC生成5caC后的一步脱羧基反应,因此该5mC去甲基化新机制不涉及DNA链的断裂、节省细胞物质和能量。研究工作对深入认识DNA表观遗传修饰的调控机制有积极意义。北京大学伊成器教授和武汉大学周翔教授对本项工作提供了帮助和支持。研究得到了国家自然科学基金的资助。该工作以Research Article 的形式发表在CCS Chemistry,已在官网“Just Published”栏目上线。
 扫描二维码,免费阅读下载原文。
扫描二维码,免费阅读下载原文。
文章详情:
Transformation of 5-Carboxylcytosine to Cytosine Through C–C Bond Cleavage in Human Cells Constitutes a Novel Pathway for DNA Demethylation
Yang Feng, Neng-Bin Xie, Wan-Bing Tao, Jiang-Hui Ding, Xue-Jiao You, Cheng-Jie Ma, Xiaoxue Zhang, Chengqi Yi, Xiang Zhou, Bi-Feng Yuan* & Yu-Qi Feng
Citation: CCS Chem. 2020, 2, 994-1008
文章链接:https://doi.org/10.31635/ccschem.020.202000286
关注CCS Chemistry 公众号,了解更多文章信息:

如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号