近红外光激发的DNA纳米传感器揭示溶酶体的酸化过程
DNA纳米传感器发展迅速,已广泛应用于生物、化学、环境等领域,尤其对细胞内生理过程的监测有着独特的优势。那么,是否可将DNA纳米传感器应用于溶酶体的酸化过程的探究呢?近日,湖南师范大学的张友玉教授(点击查看介绍)和加拿大滑铁卢大学的刘珏文教授(点击查看介绍)合作,构建了两个基于DNA组装的纳米传感器,并用于溶酶体腔内pH和钾离子(K+)的同时成像,以探究溶酶体的酸化问题。
溶酶体需维持酸性pH值才能激活水解酶,参与各种生理过程。溶酶体的酸化依赖于H+-ATPase泵入质子,该过程会产生较大的膜电势,抑制进一步的泵入。因此,需要反离子流以中和由质子积累产生的膜电势。目前,关于反离子流中和膜电势的问题仍没有清楚的答案。研究此问题需要同时测量溶酶体内两种离子的浓度,并且解决溶酶体靶向性问题。
为了确保溶酶体靶向,基于纳米颗粒的传感器可以利用内吞机制进入细胞溶酶体内。为了实现两种分析物的同时成像,近红外(NIR)光可激发的上转换纳米颗粒(UCNP)是最优选的纳米材料之一,因为它们可以吸收具有低光毒性的NIR光,耐光漂白,并具有较窄的发射峰。可高度编程的DNA是构建传感器的重要元件,其中,DNA triplex是一种响应pH的三链DNA结构,quadruplex是一种响应K+的特定DNA四链体结构。因此,DNA triplex和quadruplex构建的纳米传感器可能适用于溶酶体内H+和K+的监测。

图1. 溶酶体腔内pH和K+的相关性探究的纳米传感器的设计和成像原理的示意图。图片来源:Angew. Chem. Int. Ed.
首先通过热分解法制备了蓝光和绿光的两种UCNP,然后对UCNP表面进行配体交换修饰上聚丙烯酸(PAA)和聚乙二醇(PEG),通过EDC/NHS偶联上DNA和多肽TAT。接下来在AuNP表面连接巯基DNA和PEG。将这些UCNP和AuNP通过DNA杂交进行组装,制备DNA triplex和quadruplex传感器。透射电镜和动态光散射表明每个UCNP和一个AuNP相连接。在有靶标离子存在时,DNA发生折叠,导致AuNP靠近UCNP,发生光淬灭。最后将DNA triplex和quadruplex传感器用于体外和体内检测pH和K+,对pH和K+的响应具有较高的选择性和光稳定性。如果改变DNA序列,抑制DNA triplex和quadruplex的行程,这些control传感器则对pH和K+不再敏感(图1)。
Hela细胞内,在受ATP刺激后,DNA quadruplex 传感器的绿色UCNP信号增强,而DNA triplex传感器的蓝色UCNP信号减弱,说明了K+的外流刺激了溶酶体的酸化(图2)。
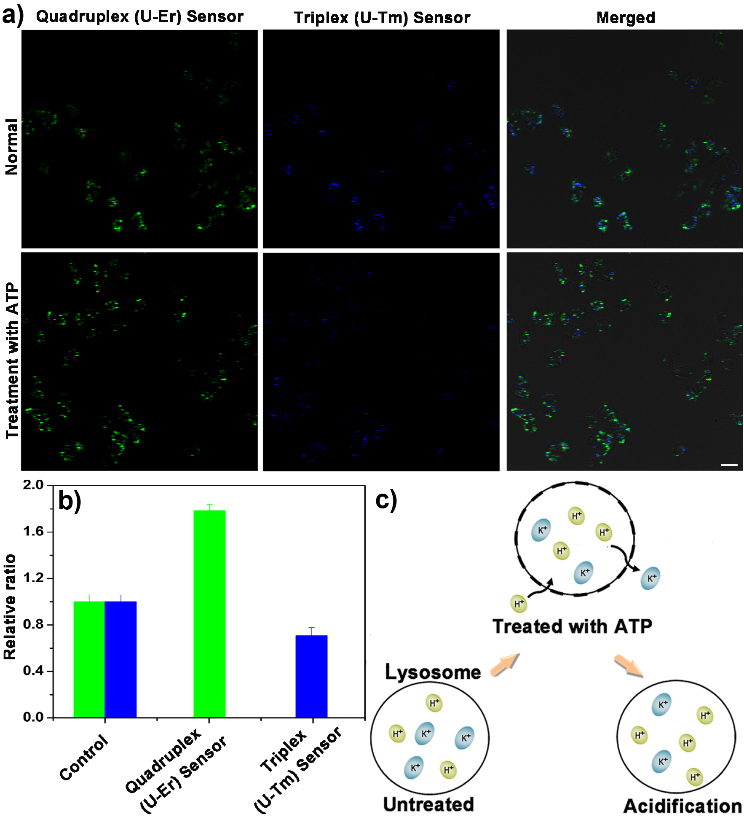
图2. DNA triplex和quadruplex纳米传感器同时孵育的Hela细胞在ATP刺激前后的共聚焦发光图,荧光定量和ATP刺激溶酶体酸化的示意图。图片来源:Angew. Chem. Int. Ed.
该工作成功地构建了单发射体-单淬灭剂的DNA triplex和quadruplex传感器,实现了对溶酶体内的pH和K+的同时成像,结果表明溶酶体酸化过程中质子的流入伴随着钾离子的流出。鉴于不同的DNA适配体序列可以检测到各种分子,该方法可以扩展到细胞中许多其他分析物的检测和成像,以应对具有挑战性的生化和细胞生物学问题。
这一成果近期发表在Angewandte Chemie International Edition 上,文章的第一作者是湖南师范大学博士研究生陈峰。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

DNA Triplex and Quadruplex Assembled Nanosensors for Correlating K+ and pH in Lysosomes
Feng Chen, Qiujun Lu, Linna Huang, Biwu Liu, Meiling Liu, Youyu Zhang, Juewen Liu
Angew. Chem. Int. Ed., 2020, DOI: 10.1002/anie.202013302
导师介绍
张友玉
https://www.x-mol.com/university/faculty/10191
刘珏文
https://www.x-mol.com/university/faculty/75566
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


















































 京公网安备 11010802027423号
京公网安备 11010802027423号