Chem. Sci.:首个靶向自噬启动因子ULK1的小分子激动剂作为抗三阴性乳腺癌的新型候选药物
注:文末有研究团队简介及本文科研思路分析
三阴性乳腺癌(TNBC)是指雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体(HER2)均阴性的一种特殊类型乳腺癌。因缺乏内分泌及抗HER2治疗的靶点,目前尚无针对性的靶向小分子药物治疗方案。因此通过新颖途径寻找新的抗乳腺癌药物具有十分重要的意义。自噬(Autophagy)是一种细胞自我降解的过程,以清除受损或多余的蛋白质和细胞器。自噬作用在机体的生理和病理过程中都可见,与多种恶性肿瘤,包括三阴性乳腺癌(TNBC)在内均密切相关。来自东京工业大学的科学家Yoshinori Ohsumi(大隅良典),因包括克隆第一个酵母自噬基因Atg1以及在内的工作而获得2016年诺贝尔生理学或医学奖。哺乳动物基因编码酵母自噬基因Atg1的同源物ULK1蛋白激酶是自噬启动和进展的重要调控因子,因此靶向自噬启动因子ULK1小分子化合物的发现成为抗肿瘤药物研究的热点。
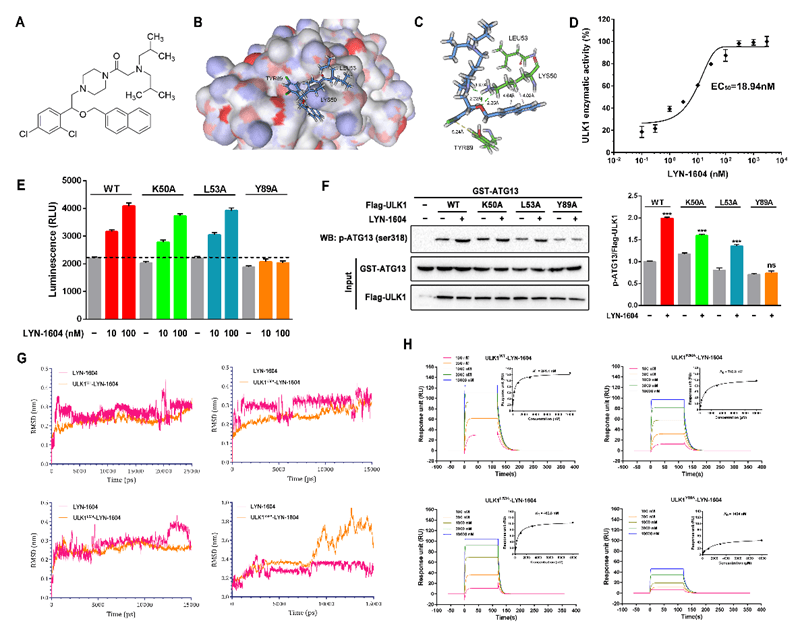
来自四川大学的科研团队通过深入合作,首次设计并发现一个靶向自噬启动因子ULK1小分子候选药物LYN-1604,并深入阐明该小分子的深入分子机制:首先通过基于癌症和肿瘤基因图谱(TCGA)的大数据分析,结合TNBC组织样本芯片验证,发现ULK1在TNBC组织样本中显著性下调,表明激动ULK1是治疗TNBC的新策略。然后基于ULK蛋白复合体结构设计并结合了高通量筛选技术,得到一个先导化合物,并合成修饰得到多个系列小分子化合物;再经过多轮ULK1激酶活性测试结合抗肿瘤活性筛选,最终发现一个强效的ULK1激动剂LYN-1604,并利用定点突变技术确定了其关键结合氨基酸,发现该小分子可通过激活ULK复合体诱导TNBC细胞发生Atg5依赖的自噬性死亡。
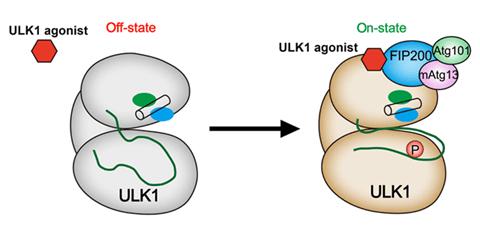
为了进一步研究LYN-1604调控的自噬机制,分别在MDA-MB-231细胞中过表达或敲低ULK1后,结合定制的基因芯片结果来构建了一个ULK1调控的核心网络,并发现一些受ULK1调控的潜在关键基因,通过实验验证LYN-1604诱导的细胞自噬性死亡与这些关键基因如ATF3,RAD21及caspase3密切相关。最后,在体内实验中发现LYN-1604具有非常好的抗TNBC效果,并通过靶向ULK1调控的(自噬性)死亡来发挥抗肿瘤作用。因此,LYN-1604作为目前首个靶向ULK1的小分子激动剂,未来可开发针对TNBC治疗的新型靶向小分子药物。目前,该工作已经申请国家专利,并已有多家制药公司对该类小分子激动剂的药物开发表现出浓厚的兴趣。
该研究结果发表在英国皇家化学会(RSC)权威化学类综合刊物《化学科学》(Chemical Science,影响因子 9.144)。第一作者由四川大学华西医院生物治疗国家重点实验室/生物治疗协同创新中心的张岚博士和符雷蕾博士共同完成,四川大学华西医院生物治疗国家重点实验室/生物治疗协同创新中心的欧阳亮副研究员和刘博副研究员为本文的共同通讯作者。该研究工作获得了多项国家自然科学基金资助。
该论文作者为:Lan Zhang, Leilei Fu, Shouyue Zhang, Jin Zhang, Yuqian Zhao, Yaxin Zheng, Gu He, Shengyong Yang, Liang Ouyang* and Bo Liu*
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Discovery of a small molecule targeting ULK1-modulating cell death of triple negative breast cancer in vitro and in vivo
Chemical Science, 2017, DOI: 10.1039/C6SC05368H
研究团队简介

欧阳亮(左),四川大学华西医院生物治疗国家重点实验室/生物治疗协同创新中心副研究员。2010年于四川大学药学院获得药物化学博士学位,2010年7月起就职于四川大学;研究方向为药物化学与化学生物学;长期从事肿瘤和神经退行性疾病靶点发现,药物化学筛选工作,以及凋亡与自噬相关分子机制信号传导的药物设计及合成方法学,在利用化学生物学手段研究凋亡和自噬等生命现象与疾病治疗领域,有较好的工作积累:近五年来,第一作者(或通讯作者)在 Chem. Sci.; Oncotarget; Sci. Rep.; Eur. J. Med. Chem.; Bioorg. Med.Chem.; Bioorg. Med.Chem. Lett.; Cell proliferation等药物化学和药理学领域主干SCI期刊上发表论文二十余篇(总引用次数>500次),其中在《Cell proliferation》发表与凋亡自噬相关的特邀综述入选Web of Science 相关领域引用次数 Top 1%的“高被引论文”,并被包括Nature Rev. Microbiol.; Autophagy; Cell Death. & Diff. 等国际知名期刊多次引用,另外还受邀作为编委参编了 Elsevier 出版的细胞自噬与药物相关英文学术专著 2本。先后主持过国家自然科学基金面上项目2项、国家自然科学基金青年基金、国家博士后基金特别资助等,获中国医药教育协会科技二等奖一项,获省部级科技进步二等奖两项。
刘博(右),四川大学华西医院生物治疗国家重点实验室/生物治疗协同创新中心副研究员。2010年于四川大学生命科学学院获得生物信息学博士学位(药物设计方向),2010年7月起就职于四川大学;研究方向为药物设计和分子药理学;长期以来利用生物信息学方法,结合多组学技术与分子药理学,对细胞自噬的新靶标识别、药物设计及其作用机制进行深入研究。尤其在针对自噬关键分子ULK1, SIRT3, eEF2K,AMPK, BRD4等设计出具有原创性的靶向小分子候选药物,并阐明其调控自噬的复杂机制和潜在治疗效果,为基于自噬新靶点的抗肿瘤、抗帕金森病的小分子药物研发奠定基础。近年来,以通讯作者或第一作者在Autophagy, Chemical Science, Medicinal Research Review, Nucleic Acids Res等期刊共发表SCI论文56篇,影响因子总计超过270 (其中9分以上论文5篇,其余5分以上的14篇),文章它引共计近1800余次。曾受邀参加学术会议并作分会报告11次;参编自噬相关学术专著10本。先后主持过国家自然科学基金项目2项、国家中医药管理局项目子课题1项、国家博士后基金1项等;获中国医药教育协会科技二等奖一项(排名第二),获省部级科技进步奖二等奖两项(排名分列第二、第三)。
科研思路分析
Q:这项研究的最初目的是什么?或者说想法是怎么产生的?
A:如上所述,我们的研究兴趣是研究开发一种通过新颖途径可用于三阴性乳腺癌(TNBC)治疗的小分子靶向药物。自噬作用在机体的生理和病理过程中都可见, 与多种恶性肿瘤, 包括TNBC在内均密切相关,2016年获得诺贝尔奖之后,自噬与相关疾病的转化医学研究成为了成为许多科学家重点关注的研究方向。我们的目标很简单,就是通过自噬启动因子ULK1设计小分子激动剂,并在肿瘤细胞中诱导自噬性死亡。幸运的是,通过多轮筛选和药物化学工作后,我们最终得到了这样一个强效的激动剂,并通过靶向ULK1调控的(自噬性)死亡来发挥抗肿瘤作用。这为高效、低毒、可靠的抗乳腺癌靶向药物设计提供了一条理想的途径。
Q:在研究中过程中遇到的最大挑战在哪里?
A:本项研究中最大的挑战是如何通过ULK复合体的结构和调控模式,获得完整的、具有优异性能的先导化合物。在这个过程中,我们团队在自噬分子生物学和药物设计方面的经验积累起了至关重要的作用。此外,这项研究属于交叉学科的研究,其中需要不少生物信息、药物化学和分子生物学方面的背景知识,而我们在四川大学生物治疗国家重点实验室/生物治疗协同创新中心的团队和平台主要来源于药物化学和生物医学等专业,因此可避免知识储备不足而带来多学科交差的挑战。未来希望有相关领域的研究者一起合作将该研究推动到更高的层次。
Q:本项研究成果最有可能的重要应用有哪些?哪些领域的企业或研究机构最有可能从本项成果中获得帮助?
A:该候选化合物是一种全新途径治疗TNBC的小分子靶向药物,目前的研究结果已经显示了良好的治疗潜力。我们相信这项研究成果能为相关疾病的治疗提供了一种性能优异的、并且可产业化的选择,将对相关领域的发展产生推动作用。
