通过亚胺的酰胺化反应来实现2H-azirine的动力学拆分
2H-azirine作为最小的含氮不饱和杂环化合物,不仅广泛存在于天然产物中,同时也是有机合成中的重要中间体。合成这类化合物的方法有很多,但其不对称催化合成目前仍然只局限于Neber反应,然而通过不对称Neber反应合成的2H-azirine的二位取代基只能是酯基,其原因是酯基在反应中需要与催化剂形成氢键,从而选择性的识别并消去亚甲基上的氢原子。因此,如何通过不对称催化的方法合成二位为非酯基取代的2H-azirine引起了化学家们的思考。考虑到2H-azirine中的C=N官能团,四川大学化学学院冯小明教授(点击查看介绍)、刘小华教授(点击查看介绍)及其合作者设想采用亲核试剂在手性催化剂的作用下,专一性的从2H-azirine的一面去进攻,最终通过动力学拆分的方式来得到手性2H-azirine。
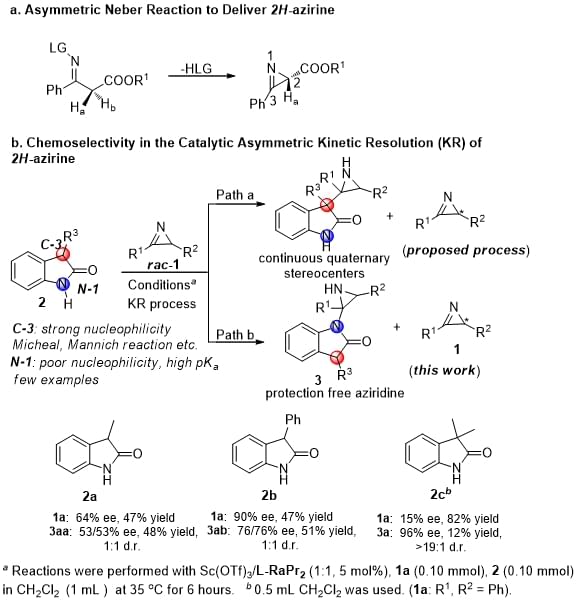
在尝试了一系列的亲核试剂后,研究团队发现吲哚酮作为亲核试剂可以给出很好的拆分效果。与以往报道的反应不同是,吲哚酮亲核性较弱的1位氮原子优先于其3位发生反应。
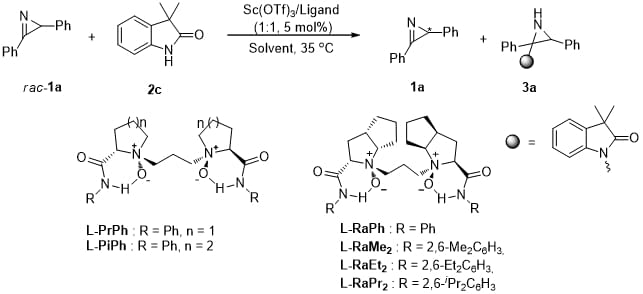
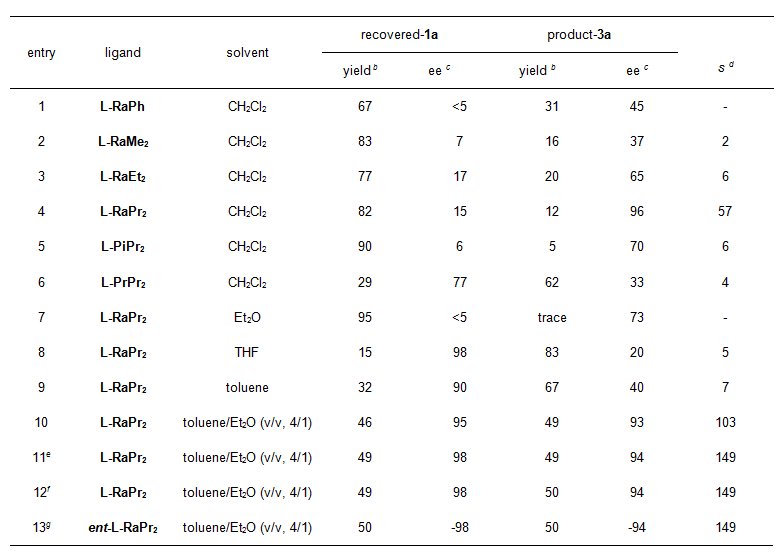
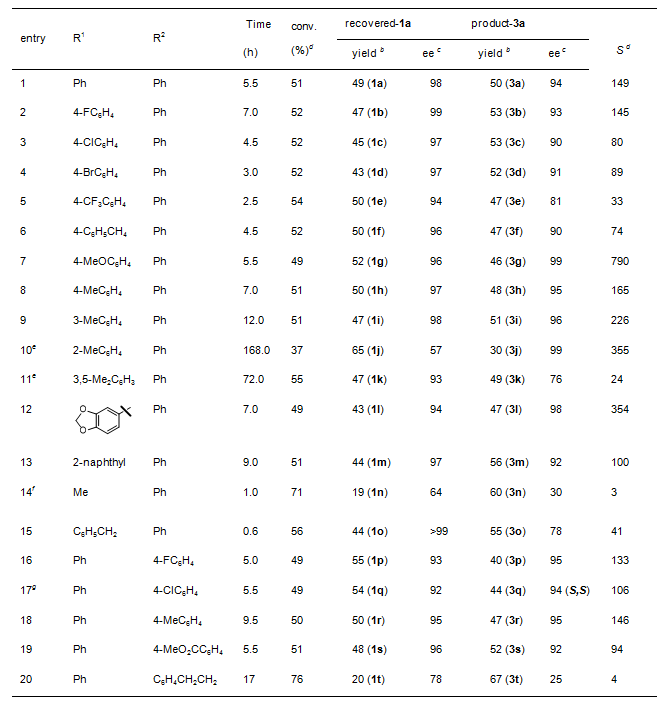
首先选择吲哚酮2c和2H-azirine 1a作为模板底物对反应条件进行了优化,最终确定了以Sc(OTf)3/L-RaPr2配合物作为最优催化剂,在THF和Toluene的混合溶剂中,可以取得优异的结果,反应的S值可最高达149。
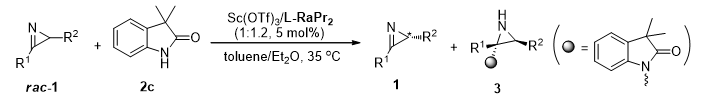
在最优条件下,研究团队对底物的普适性进行了考察。如图所示,不管R1是芳基还是烷基,都能给出优秀的结果,尤其是当R1为对甲氧基取代时,拆分的S值可高达790。同时也对R2进行了考察,芳环上无论是吸电还是供电基,都能得到很好的拆分效率,并且当R2为苄基时,回收的2H-azirine仍具有中等的对映选择性。
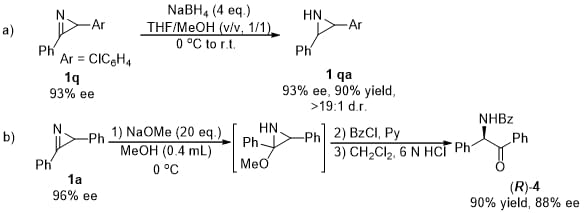
最后对产物进行了衍生,2H-azirine既可以立体专一性的被直接还原成非保护的吖啶,也可以生成苯甲酰基保护的氨基酮。
总之,采用金属氮氧配合物作为催化剂,通过动力学拆分的方式,高选择性的得到了各种非酯基取代的2H-azirine。
该论文作者为:Haipeng Hu, Yangbin Liu, Lili Lin, Yuheng Zhang, Xiaohua Liu, Xiaoming Feng
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Kinetic Resolution of 2H-Azirines by Asymmetric Imine Amidation
Angew. Chem. Int. Ed., 2016, 55, 10098-10101, DOI: 10.1002/anie.201605251
导师介绍
冯小明院士
http://www.x-mol.com/university/faculty/12766
刘小华教授
http://www.x-mol.com/university/faculty/12781
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号