手性磷酸催化硫(IV)叶立德不对称N–H插入反应
自从1930年Ingold和Jessop报道了第一例硫叶立德(IV)的合成以来,特别是经Johnson和LaCount,Franzen,及Corey和Chaykovsky先驱性的研究硫叶立德与羰基化合物的反应性质后,硫叶立德化学研究逐渐成为有机合成化学中的重要领域之一,已经取得了大量研究进展。与之鲜明对比的是,利用硫叶立德作为底物,在不对称催化领域的进展则相对较少。少数已报道的文献主要集中于利用硫叶立德作为C1合成子进行不对称环加成反应;此外,在金属催化X–H插入反应中,前手性硫叶立德仅作为重氮化合物的等价物来产生金属卡宾中间体参与反应,并且尚未出现高效的不对称催化反应报道。
硫叶立德作为一种两性离子化合物,一般需要在α–位引入吸电子基来稳定其存在,但如此一来其反应活性又会受限于稳定基的种类与数目;同时根据硫叶立德价态的不同,当羰基作为稳定基时,具有前手性的非环硫(IV)叶立德往往以顺反异构体混合物的形式存在。因此,发展硫叶立德本身独有的X–H不对称插入反应具有重要意义并充满挑战。
α–氨基酮广泛存在于天然产物和药物活性分子中,且可以作为重要的手性砌块β–氨基醇的合成中间体,因此其不对称催化合成方法吸引了化学工作者极大的研究兴趣。X-MOL去年曾报道了北京化工大学李平凡副教授(点击查看介绍)团队发展的锍鎓亲电试剂参与内炔烃双官能化反应(Chem. Sci., 2019, 10, 5156-5161,点击阅读详细),可合成多种α-杂原子取代的酮,其中包括一个手性布朗斯特酸催化的α–氨基酮的例子(50% ee)。近日,李平凡团队和香港科技大学孙建伟教授(点击查看介绍)团队合作在JACS 报道了手性磷酸催化硫(IV)叶立德不对称N–H插入反应,以优秀的对映体选择性和良好的分离收率得到一类手性α–氨基酮产物(图1)。经过简单的衍生反应,产物可以转化成一系列有用的手性产物,并对反应机理进行了详细的阐释和修正。
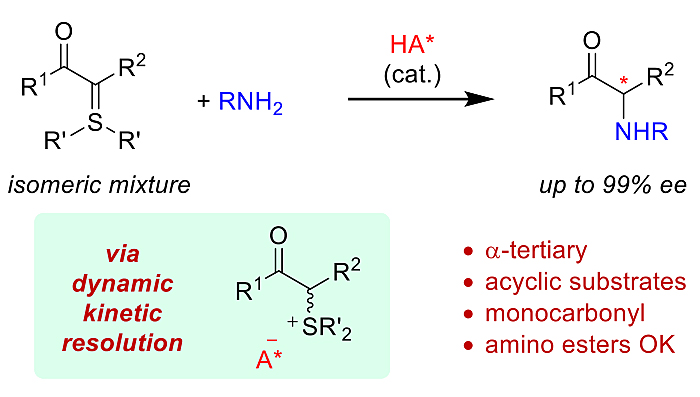
图1. 手性磷酸催化硫(IV)叶立德不对称N–H插入合成手性α–氨基酮。图片来源:J. Am. Chem. Soc.
优化反应条件之后,作者对底物范围进行了考察(图2)。需要指出的是,为了扩大底物的适用范围和提高某些产物的对映体选择性,在含α–甲基的硫叶立德作为底物时,反应结束后一锅加入催化量的醋酸铜(II),经过铜催化的需氧脱氢氧化动力学拆分,牺牲少许收率即可得到一大部分近乎光学纯的产物。同时,作者也给出了一些例子证明一些反应中并不需要加入醋酸铜。
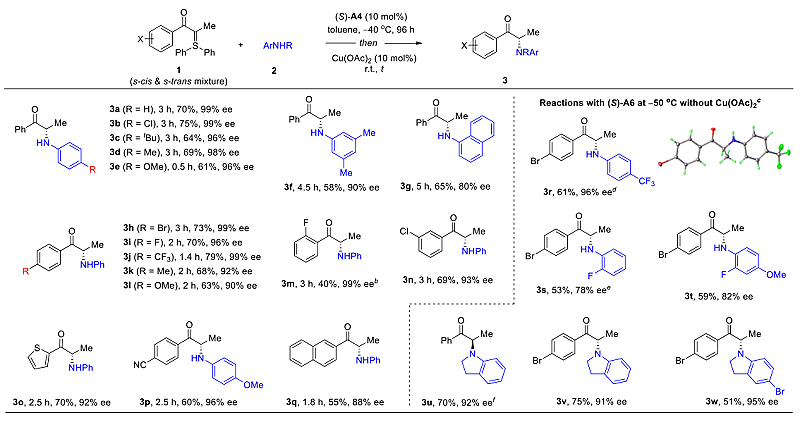
图2. 合成手性α-氨基苯丙酮衍生物。图片来源:J. Am. Chem. Soc.
随后作者利用一系列含α–长链烷基的硫叶立德作为底物,在几乎相同的反应条件下,也得到了非常优秀的对映体选择性(图3)。有趣的是,在相同手性构型催化剂作用下,图2及图3中的产物,经过单晶衍射确认具有不同的绝对构型。
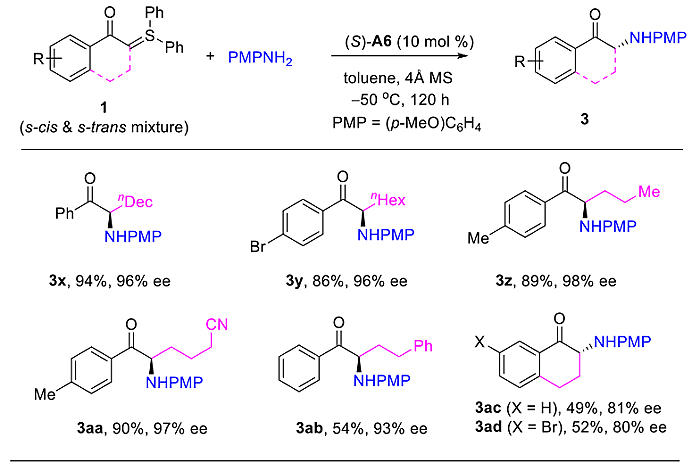
图3. α–长链烷基手性氨基酮的合成。图片来源:J. Am. Chem. Soc.
为了进一步证明反应的底物适用性,作者考察了具有不同位阻和侧链的α–酯基稳定的硫叶立德,并优化出了两类新型手性磷酸催化剂,成功得到了较好收率和对映体选择性的氨基酸酯产物(图4)。
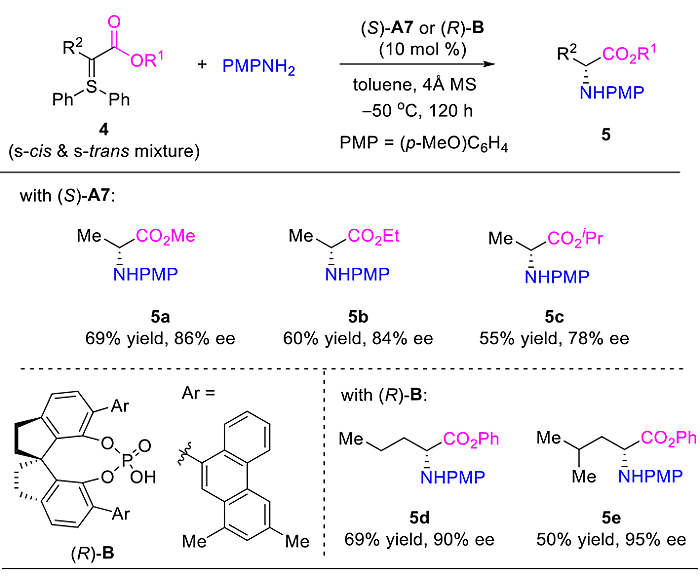
图4. 手性α–氨基酸酯的合成。图片来源:J. Am. Chem. Soc.
为了证明反应的应用潜力,作者对获得的氨基酮产物进行了合成转化研究(图5)。比如,经过简单的N–PMP脱除反应,即可得到天然产物卡西酮盐酸盐6或其N–Boc保护产物7,7作为合成中间体利用已知反应路线即可获得药物活性分子8和9。此外,针对产物中的羰基也可以进行丰富的化学转化来获得在不对称催化中具有重要用途的手性氨基醇配体及烯丙胺产物。最后,利用DDQ脱氢氧化可以将产物3v中的吲哚啉骨架转化成吲哚骨架。在整个合成转化过程中,产物的光学纯度几乎未受到影响。
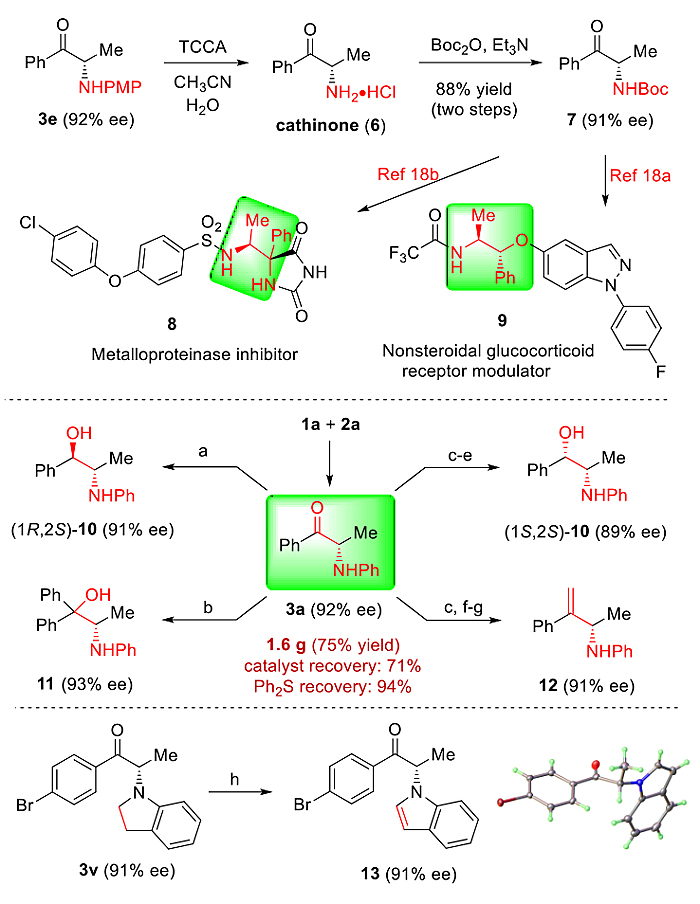
图5. 产物合成应用。图片来源:J. Am. Chem. Soc.
最后,作者对反应机理进行了详细的阐释。首先,由于研究中利用的硫(IV)叶立德底物都是顺反异构体混合物,而所得产物具有很好的对映体选择性,因此可排除不对称质子化是反应的对映体控制步——从而修正了质子化确立手性中心、继而SN2反应立体专一性构型翻转的机理假设(Chem. Sci., 2019, 10, 5156, Scheme 4);同时也与Mattson和Burtoloso等人近期发表在《德国应用化学》上的相关反应机理形成了鲜明对比(Enantioselective S-H Insertion Reactions of α-Carbonyl Sulfoxonium Ylides. Angew. Chem. Int. Ed., 2020, DOI: 10.1002/anie.202005563)。31P NMR实验证明反应体系中磷物种的单一性(图6),进一步佐证了对映体控制步是质子化后形成的手性离子对IM的动态动力学(DKR)拆分。同时在原位31P NMR表征时,作者观察到两组新的磷信号的产生(图6)。
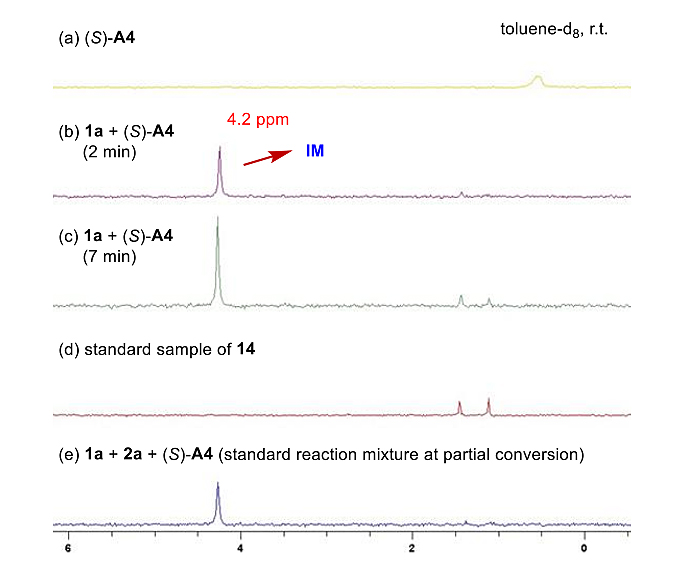
图6. 反应中间体的磷谱表征。图片来源:J. Am. Chem. Soc.
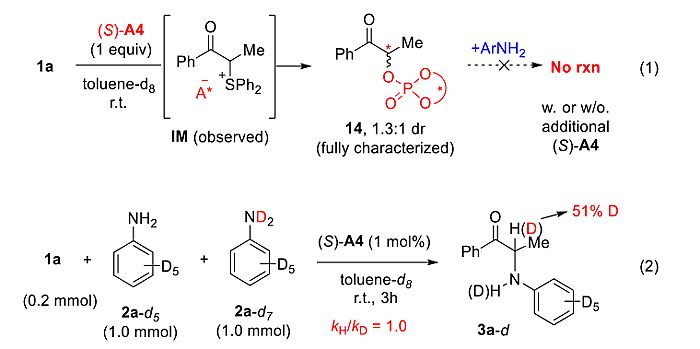
控制实验结果表明,新的磷谱信号是催化剂被硫叶立德烷基化后形成的副产物14,并且其非反应活性中间体(方程1)。KIE实验证明质子化过程非反应速控步(方程2)。
最后作者发现反应具有很强的正的非线性效应。根据已知的文献报道,这种现象是由非光学纯的催化剂在反应条件下团聚形成非单一手性的团聚体沉淀,从而致使溶解态的催化剂光学纯度提高所致,催化剂的溶解性实验进一步支持了该种设想(图7)。
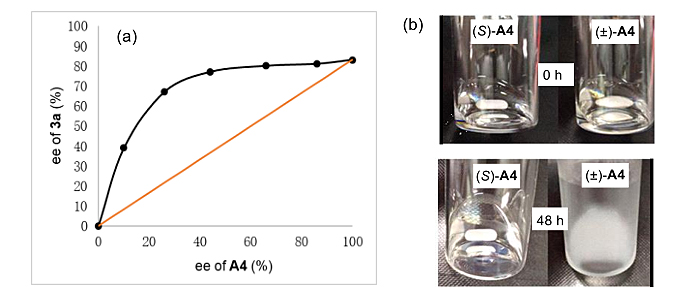
图7. 非线性效应及催化剂在反应温度下的溶解性实验。图片来源:J. Am. Chem. Soc.
根据以上实验结果,作者提出了反应的可能机理(图8)。在该催化循环中,手性离子对IM的高效动态动力学拆分是反应获得高对映体选择性的关键;动力学实验证明了反应过程中C–N的形成是反应速控步。
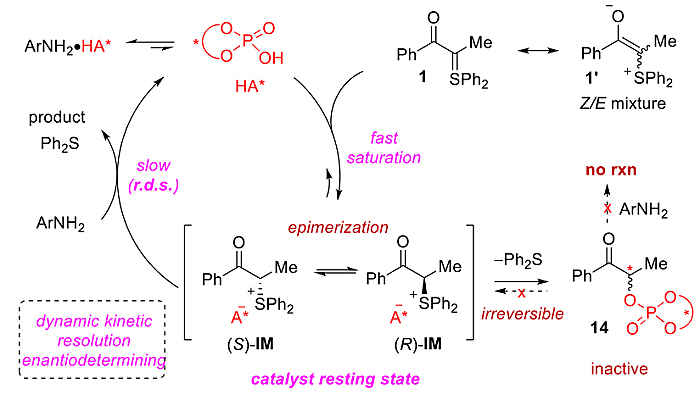
图8. 反应机理。图片来源:J. Am. Chem. Soc.
这一成果近期发表在Journal of the American Chemical Society上,文章第一作者为香港科技大学郭文岗博士和北京化工大学硕士研究生罗宇政,通讯作者为香港科技大学孙建伟教授和北京化工大学李平凡副教授。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Chiral Phosphoric Acid Catalyzed Enantioselective Synthesis of α-Tertiary Amino Ketones from Sulfonium Ylides
Wengang Guo, Yuzheng Luo, Herman H. Y. Sung, Ian D. Williams, Pingfan Li, Jianwei Sun
J. Am. Chem. Soc., 2020, DOI: 10.1021/jacs.0c07210
导师介绍
李平凡
https://www.x-mol.com/university/faculty/8727
孙建伟
https://www.x-mol.com/university/faculty/7073
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
北京化工大学Chem. Sci.:锍鎓亲电试剂参与的内炔烃双官能化合成α-杂原子取代的酮 2019-05-02
-
Rh催化硫叶立德与(杂)芳香烃C-H键的交叉偶联反应 2017-10-05
-
钌催化的硅炔偕位硼氢化反应与机理研究 2020-07-28
-
Chem. Soc. Rev.:催化的硫叶立德环化反应近期发展现状 2018-01-07


































 京公网安备 11010802027423号
京公网安备 11010802027423号