通过自由基接力策略铜催化的不对称苄位碳氢键炔基化反应研究
手性的炔丙基片段通常能在天然产物和活性药物中找到,例如依法韦仑(一种商业抗艾滋病毒的特效药物)和AMG 837。同时,炔烃官能团在合成化学中有着非常广泛的应用,比如炔烃可以被还原成烯烃和烷烃,可以被氧化成羧酸,可以参与点击化学反应等等。由于碳氢键直接转化的高效性,因此发展碳氢键的不对称炔基化来实现手性炔丙基化合物的合成受到了化学家们的广泛关注。
中国科学院上海有机化学研究所刘国生(点击查看介绍)团队发展了铜催化自由基接力策略用于碳氢键的 不对称官能化,成功地实现了苄位及烯丙位碳氢键的氰化、芳基化等反应(Acc. Chem. Res., 2018, 51, 2036; Science, 2016, 353, 1014; Nature, 2019, 574, 516; Angew. Chem. Int. Ed., 2019, 58, 6425);另外,该课题组还基于该策略,发展了烯烃的不对称炔基化反应(J. Am. Chem. Soc., 2018, 140, 10965)。在这些工作的基础上,他们团队与香港科技大学林振阳(点击查看介绍)课题组合作成功实现了烷基苯类底物苄位碳氢键不对称炔基化反应,并对反应的机理进行了深入研究。作者通过对反应条件的优化,包括反应溶剂、手性配体和N-氟代双芳基磺酰胺的考察,确定了反应的最优条件。随后作者对反应的底物范围进行了拓展,发现反应对α位烷基取代的萘类底物展现出很好的活性和对映选择性。对于普通烷基苯以及芳基杂环的底物,反应以中等收率和高对映选择性得到目标产物。同时,作者也对炔基化试剂进行了考察,发现不同取代的烷基/芳基炔基硅底物也适合该反应。需要特别指出的是,反应可应用于活性分子Splitomicin后期官能团修饰。同时,作者通过对底物6选择性苄位碳氢键不对称炔基化以及对炔基化产物的一步脱硅转化,实现了对重要活性分子AMG 837的关键中间体的不对称合成。最后,作者对手性碳氢键炔基化产物做了进一步炔基官能团转换,合成了一系列含有不同官能团的手性化合物。
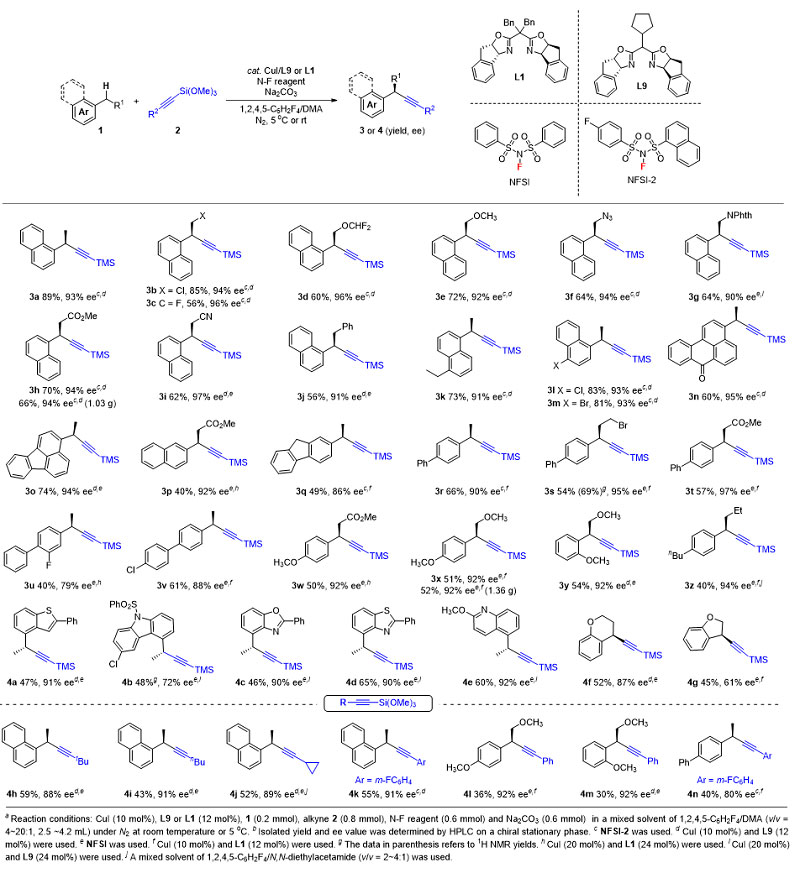
图1. 苄位碳氢键的不对称炔基化反应
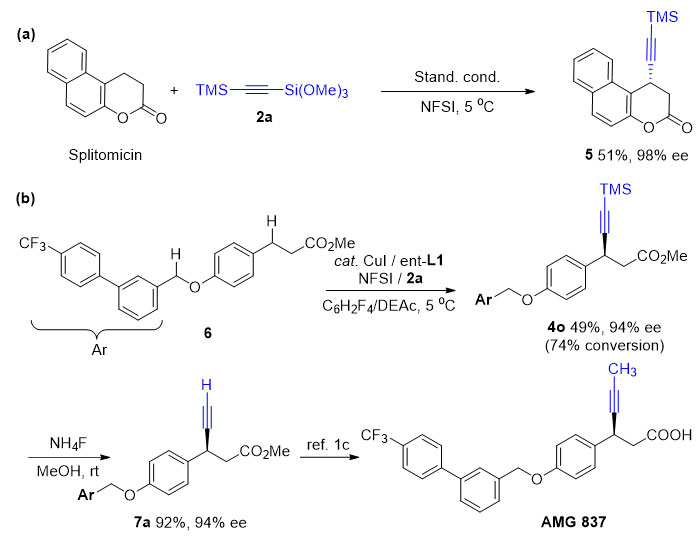
图2. 合成应用
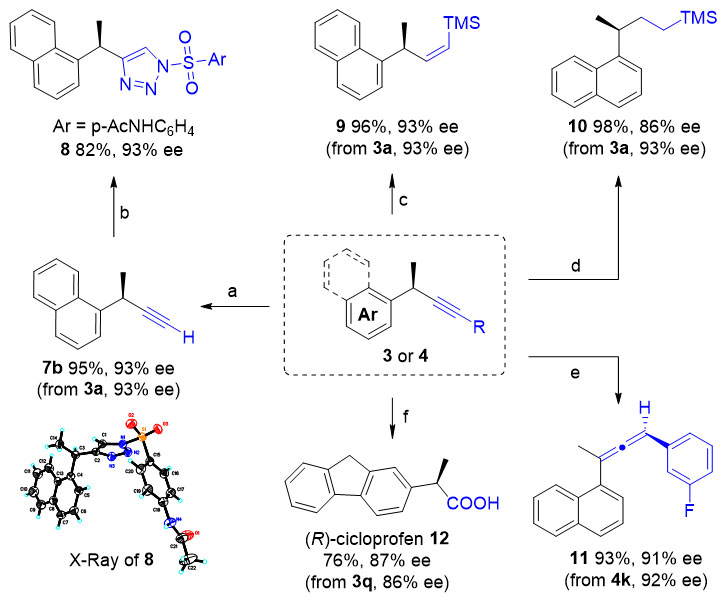
图3. 产物转化
作者对该新反应做了深入的机理研究。他们在标准反应中加入四甲基哌啶氮氧自由基抑制剂,反应被完全抑制;加入三氯溴甲烷,观测到了苄位碳氢键溴化的产物。上述结果表明反应可能经历了一个自由基历程。通过对苄位碳氢键一级动力学同位素效应研究(竞争实验KIE= 5.0;平行实验KIE = 2.27)表明苄位碳氢键断裂参与了反应的决速步骤。最后,作者对二价炔基铜活性中间体与苄位自由基的结合方式进行了研究,当在炔基化试剂的端位引入一个环丙基或者在炔丙位引入一个砜基时,反应以很好的物料平衡只生成碳氢键炔基化反应产物。该实验结果表明,二价炔基铜活性中间体与苄位自由基的结合并没有经历铜外层机制。
为了进一步探究反应的机理,作者对自由基加成步骤进行了DFT计算研究。计算结果表明,苄基自由基与二价铜中间体反应时,从位阻较小的方向进攻二价铜中心。与传统的[Cu(II)+自由基→Cu(III)→Cu(I)+产物]模式不同,苄位自由基进攻二价金属铜和碳-碳键生成是协同过程;反应的过渡态本身的几何结构介于四方锥和三角双锥之间,非常类似三价铜中心。计算所得的R 和S 构型的能垒差为2.6 kcal/mol,很好地还原了实验结果的不对称选择性;与R 构型过渡态相比,S 构型的过渡态中,苄基自由基会遇到来自配体和炔基较大的位阻,因而能量较高。
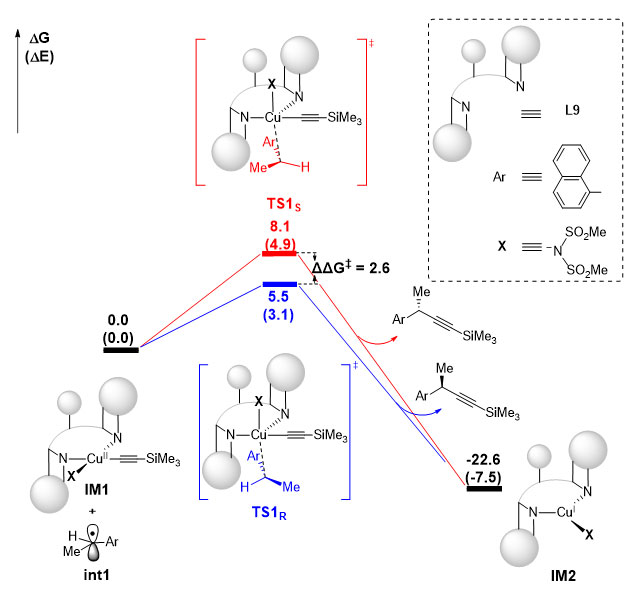
图4. DFT 计算结果
综上,刘国生与林振阳团队报道了一类新颖的通过铜催化自由基接力策略的不对称苄位碳氢键炔基化反应,该反应底物范围广泛、官能团兼容性好和反应条件温和。作者通过对反应产物的一步脱硅基转化,该方法学还被应用于活性分子AMG 837的重要中间体合成。实验和计算结果表明,二价炔基铜活性物种与苄位自由基的结合经历了三价铜中心的过程。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enantioselective Copper-Catalyzed Alkynylation of Benzylic C–H Bonds via Radical Relay
Liang Fu, Zhihan Zhang, Pinhong Chen, Zhenyang Lin*, Guosheng Liu*
J. Am. Chem. Soc., 2020, DOI: 10.1021/jacs.0c05373
导师介绍
刘国生
https://www.x-mol.com/university/faculty/15593
林振阳
https://www.x-mol.com/university/faculty/38301
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号