Nature:在生命的原点,DNA可能不会管RNA叫爸爸
“我们的实验证明了它们是好兄弟,DNA可能不会管RNA叫爸爸。”
—— J. Sutherland
生命物质起源问题向来是化学和生命科学中的皇冠,也似乎是不可能完成的任务。核苷酸、氨基酸,这些物质的起源发生在近40亿年前,绝大部分证据都早已湮没。同时,它们的形成在我们已知的世界中只发生过一次,没有可以归纳总结的基础。但是,这些并没有驱散化学工作者对这个问题的兴趣。经过长期艰苦的努力,Sutherland、Carell、Szotack等人分别领导的研究团队在生物分子的前生物合成(prebiotic synthesis)领域都取得了丰硕的成果。
不同于常规的有机合成方法学和天然产物全合成,前生物合成要求研究者只能使用有明确科学证据的、在生命起源前环境下可以形成的有机无机小分子,并且要求研究者考虑原始地球的地质和大气条件,这就为前生物合成平添许多束缚。此外,核苷酸、氨基酸中众多的手性碳原子,以及沉淀、结晶、蒸发等生命起源前环境中有限的分离纯化方式也极大地增加前生物合成的研究难度。2009年,Sutherland 等人在Nature 杂志上报道了以2-氨基恶唑和甘油醛生成阿拉伯糖氨基恶唑啉(AAO)为关键反应的嘧啶核苷酸前生物合成路线(Nature, 2009, 459, 239)。其中光学纯的AAO可以反应体系中直接结晶得到,AAO和氰基乙炔反应构成嘧啶六元环,但不影响1位β-碳氮糖苷键,从而有效解决了核糖核苷1'和2'碳的手性问题。十年来,Sutherland 团队一直致力于完成嘌呤核苷的前生物合成途径,但收效甚微。2019 年,Carell 团队在Science 上报告了经由类似的3-氨基异恶唑中间体合成嘧啶和嘌呤核糖核苷的研究工作(Science, 2019, 366, 76),其路径直接使用了化学纯和光学纯的五碳糖,但这些糖的起源途径还不得而知。总之,有效合理的嘌呤核苷的前生物合成路线一直悬而未决。
近日,Nature 正式刊发了英国剑桥分子生物学实验室 John Sutherland团队“十年磨一剑”式的研究成果——嘌呤脱氧核苷的前生物合成路径,他们以高收率以及完全的立体、区域和呋喃糖基选择性实现了脱氧腺苷和脱氧肌苷的前生物合成。合成使用了经典的嘧啶核糖核苷(胞苷和尿苷)前生物合成中的关键中间体,并且,这些嘧啶一旦生成就会在嘌呤脱氧核糖核苷的整个合成过程中一直存在,从而形成脱氧腺苷、脱氧肌苷、胞苷和尿苷的混合物。这些结果支持了嘌呤脱氧核苷和嘧啶核苷可能在生命出现之前并存的观点。

图1. John Sutherland博士。图片来源:剑桥国家分子生物学实验室
人们很早证实,在原始地球环境下,5个氢氰酸分子聚合可以生成一个腺嘌呤分子(Nature, 1961, 191, 1193)。硫氰酸铵(NH4SCN)或硫脲((NH2)2CS)也都是曾报道的生命起源前地球上含量丰富的小分子前体。本文中研究者将腺嘌呤的自然水解产物连三氨基嘧啶与硫氰酸铵或硫脲反应,得到8-巯基腺嘌呤(16)(图2)。与前文提到的AAO在1'和2'碳都手性相反的非对映异构体核糖氨基恶唑啉(RAO)(10)和氰基乙炔(11)反应生成α-脱水胞苷(12)。8-巯基腺嘌呤(16)与12或α-脱水尿苷(15)在150 ℃的干态下反应,辅以氯化镁,以68% 和87% 的转化率得到硫代脱水嘌呤核苷(18)及其7位氮苷异构体(19)。在反应中8-巯基腺嘌呤(16)的巯基孤对电子SN2进攻核糖2'位碳,16的9位或者7位氮原子上孤对电子SN2进攻核糖1'位碳,糖环构型反转为β-糖苷,嘧啶环脱离核糖,嘌呤环取而代之。
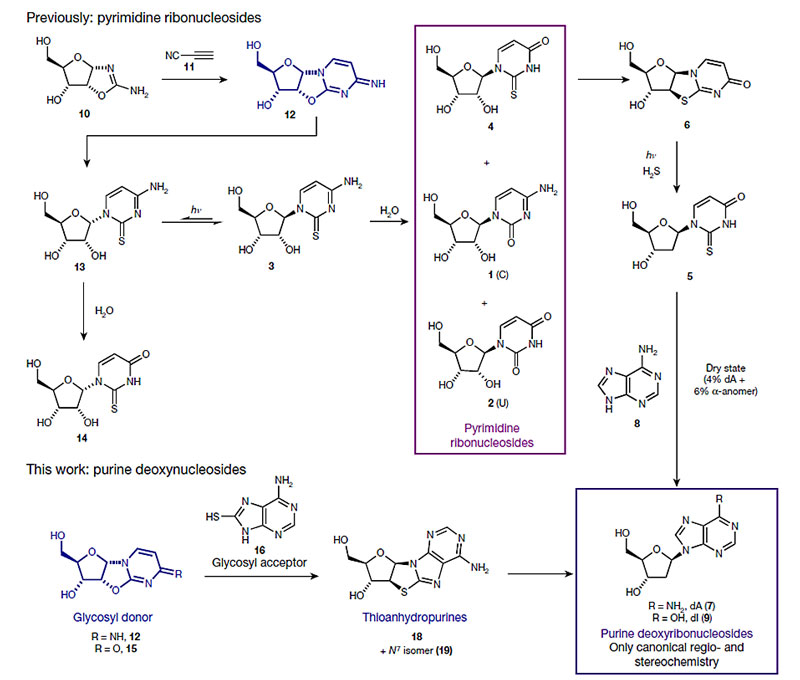
图2. 本文和前文报道的嘧啶核苷、腺嘌呤脱氧核苷的前生物合成路线。图片来源:Nature
根据之前报道的相似的反应条件(Nat. Chem., 2019, 11, 457),经过光还原反应,18以39%的收率转化为脱氧腺苷(7)。如此的产率在前生物合成化学中已经非常可观。更值得注意的是,在光还原反应的产物中,所期望的脱氧腺苷9-氮苷产物(7)和7-氮苷异构体(20)与反应原料中18、19相比比例上升。同时研究者发现,在室温和弱酸性水溶液中,7的水解速率是其异构体的1/70。这些结果说明天然脱氧腺苷在人为条件和自然环境下都更为稳定。
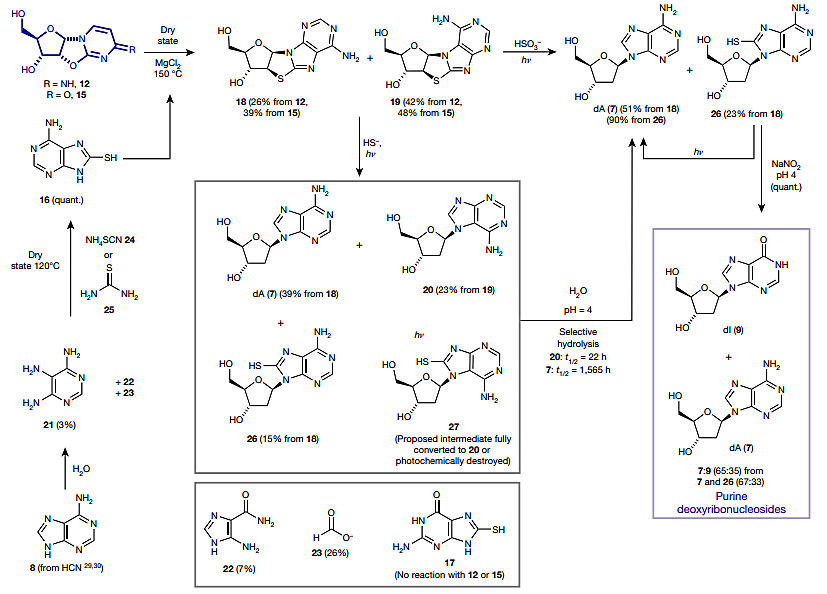
图3. 嘌呤脱氧核苷的前生物合成路线。图片来源:Nature
作者报道,在同样条件下使用8-巯基鸟嘌呤并没有得到脱氧鸟苷。毕竟目前尚不能确定,现代生命体系中的鸟苷同样存在于原始地球生命系统中。另一方面,脱氧腺苷7可以在亚硝酸环境(pH = 4)脱氨水解,以40%收率生成脱氧肌苷(9)。而(脱氧)肌苷可以代替鸟苷与胞嘧啶核苷高保真配对(图4)。可惜的是,作者没有给出从肌苷转化为鸟苷的有效方法。相同的条件也使胞嘧啶脱氨水解为尿嘧啶,从而实现了在同一体系中从2-巯基胞嘧啶核苷出发经过脱氨水解、高温共热、紫外光还原和再次脱氨水解四步生成脱氧腺苷(7)、脱氧肌苷(9)、胞苷(1)和尿苷(2)四种(脱氧)核苷的化学反应(图5)。在该过程中,立体选择性(β-或α-糖苷键)、区域选择性(腺嘌呤9-或7-取代)和呋喃环选择性(五元环或六元环)都得到了保证。堪称“简洁但不简单”。
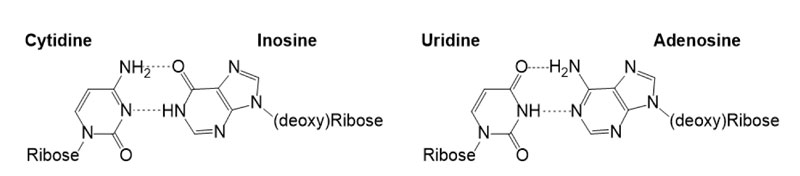
图4. 文中提及的四种(脱氧)核苷的配对关系
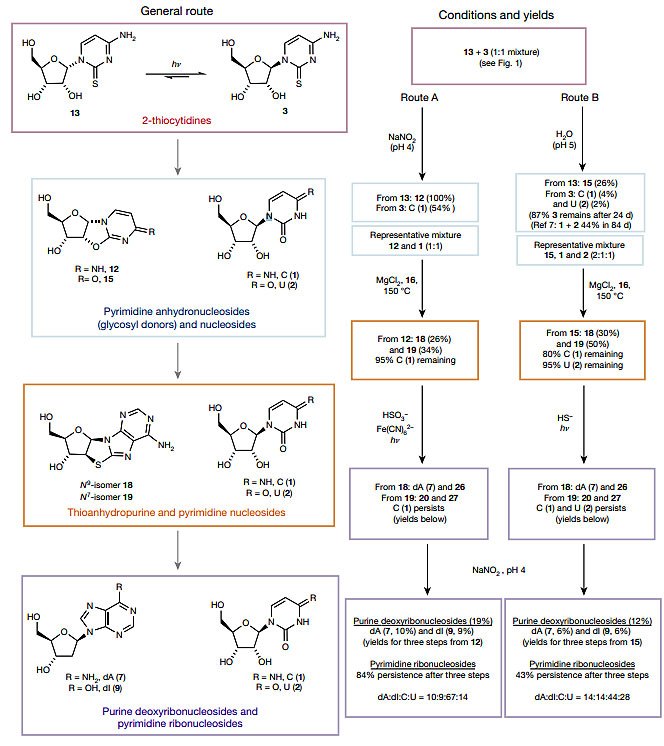
图5. 同一体系中产生四种(脱氧)核苷的方法。图片来源:Nature
根据这些结果,作者质疑传统的“RNA世界”假说。该假说认为,RNA核苷是最早出现的生命物质;它不但可以客串DNA脱氧核苷以记载和传递遗传信息,也可以扮演现代生命系统中的蛋白质来催化各种生物化学反应;DNA和蛋白质是RNA进化的产物。然而RNA远不如DNA稳定,其催化能力也非常有限且仅存在于长链RNA中,目前尚没有证据证明单独的RNA分子可以自我复制。
Sutherland说:“任何人一看它们的结构都会认为RNA和DNA长的很像,我们的实验证明了它们是好兄弟,DNA可能不会管RNA叫爸爸。”(“This work really suggests that they’re molecular siblings, as opposed to one being the parent of the other.”)。本文作者更倾向认为,RNA并不孤独,核苷可以有效地脱氧还原为脱氧核苷,RNA和DNA二者的出现没有明确的时间界线。核糖与脱氧核糖结合不同的碱基,共同担负起传递信息、催化反应的任务。糖苷键的断裂、碱基的水解迭代发展出了现代生命体系中更完善核酸结构系统和它们的表观修饰产物。核酸、多肽和脂类则慢慢在历史的长河中互相影响,不断演化,孕育生命。
剑桥大学徐剑锋博士和Václav Chmela 为本工作的共同第一作者,爱丁堡大学和华沙科技大学的同事对本文亦有贡献。作者感谢MRC和Simons 基金会的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Selective prebiotic formation of RNA pyrimidine and DNA purine nucleosides
Jianfeng Xu, Václav Chmela, Nicholas J. Green, David A. Russell, Mikołaj J. Janicki, Robert W. Góra, Rafał Szabla, Andrew D. Bond, John D. Sutherland
Nature, 2020, 582, 60–66, DOI: 10.1038/s41586-020-2330-9
(本文由萌哥供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号