首个自给自足P450酶全长晶体结构与电子传递机理研究
近日,湖北大学生命科学学院、省部共建生物催化与酶工程国家重点实验室陈纯琪教授(点击查看介绍)研究团队和马立新教授(点击查看介绍)、郭瑞庭教授(点击查看介绍)共同合作,针对从1980年代P450酶首次解析以来,迄今数十年来全长的自给自足P450酶结构获取困难、电子传递方式和通路不明晰等问题,解析了来源于Tepidiphilus thermophiles 的CYP116B46的晶体结构,结构信息有助于阐明分子内电子传递的方式,这是迄今为止首次报导的自给自足P450酶的全长三维结构,可作为探索该类P450特征的重要指导,且对P450酶在医药和工业领域的应用具有重要价值。该研究成果已在2020年5月29日于Nature Communications 上发表,并受到美国化学会C&EN及欧洲化学会ChemistryViews撰文特别报导。

带有血红素 (heme) 的细胞色素P450酶 (cytochrome P450),是一类广泛存在于各种生物体的金属酶,参与许多天然产物的合成途径与毒物和药物代谢反应。P450酶催化多能性很高,涉及20余类反应 (包括羟化反应、环氧化反应和成环反应等),具有高度区域和立体选择性,底物谱极广,可以识别芳香族、聚酮类、萜类、肽类、糖类等类型的底物,拥有“万能生物催化剂之称”。此外,P450酶的底物结合区具有高度可塑性,透过酶工程改造可以改变底物谱,在重要化学品和药物制造方面的应用深具潜力。绝大多数P450酶需要氧化还原酶来提供电子以活化底物结合区的血红素,进而转化底物。所以建立一个P450系统必须寻找同源或者相匹配的氧化还原酶。自给自足 (self-sufficient) 的P450酶自带氧化还原酶在同一条多肽链上,免除了寻找相对应的氧化还原酶,在生物技术应用方面是极具吸引力的生物催化剂。而自给自足P450酶内部电子如何传递是一个有趣且重要的课题。
目前已知的自给自足P450酶有两类,第一类以来源于巨大芽孢杆菌的CYP102A1 (P450-BM3) 为代表,由氮端的P450血红素 (heme) 结构域,与碳端的P450还原酶 (C-terminal NADPH:cytochrome P450 reductase,CPR) 组成 (图1a),电子传递的方向是NADPH→FAD→FMN→heme。通过P450-BM3部分结构和哺乳动物来源的CPR结构报导,对于这类P450酶的电子传递机理已经有了一些推论。首先,在P450-BM3的FMN结合区和heme结合区复合体结构中,两个氧化还原中心之间的距离约18 Å左右,显示这个结构可能捕抓到了电子从FMN传递到heme的型态 (图1b)。另一方面,哺乳动物来源的CPR晶体结构报导显示,FAD/NADPH结合域与FMN结合域之间可能发生很大的构像变化 (图1c),根据结构信息推断,电子可能从NADPH通过FAD传到邻近的FMN,接着FMN结合域展开,使FMN接近heme结合域,完成电子传递的过程。另外一个理论则认为这一类的P450酶是通过形成同源二聚体,来进行分子内与分子外两种途径的电子传递。由于此类P450酶的完整全长结构尚未成功解析,电子传递的机理仍需进一步的厘清。
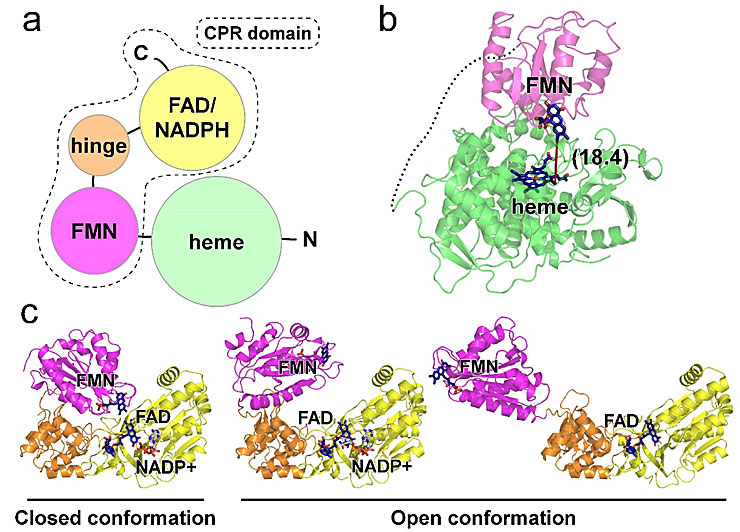
图1. 第一类自给自足P450酶结构域排列 (a) P450-BM3结构域分布图;(b) P450-BM3部分晶体结构 (PDB ID, 1BVY),绿色区域为heme结合域,粉色区域为FMN结合域,红色虚线标示FMN与heme之间的直线距离,括号内为长度 (单位,Å); (c) 数个CPR晶体结构,黄色为FAD/NADPH结合域,橘色为hinge区域,粉色同样为FMN结合域。最左边为来源于大鼠的CPR (PDB ID,1AMO),呈“closed” 构型,中间与右边分别为来源于大鼠 (PDB ID, 3ES9) 与酵母-人融合的CPR (PDB ID,3FJO),呈“open” 构型。所有结合在蛋白质中的辅酶以棒状模型表示。
第二类是CYP116,本研究所涉及的CYP116B46就属于这一类,这些P450酶由氮端的 heme结构域和碳端的邻苯二甲酸二加氧酶还原酶类结构域 (phthalate dioxygenase-type reductase domain,PDR) 组成,PDR包含了FMN-依赖的还原酶结构域与铁氧还蛋白结构域 (ferredoxon) (图2a)。这类P450酶的电子传递方向是NAD(P)H→FMN→[2Fe-2S]→heme。有一些heme结构域单独存在的P450酶,也利用PDR作为电子供体,它们与铁氧还蛋白的复合体结构报导显示 [2Fe-2S] 与heme之间的距离大约在13 Å左右 (图2b)。然而,自给自足P450酶的一条多肽链内是如何将电子从NAD(P)H传递到heme的,和上述第一类P450酶一样,由于数十年来缺乏全长的蛋白质结构信息,电子如何传递直到本文的结构解析之后才完整阐明。
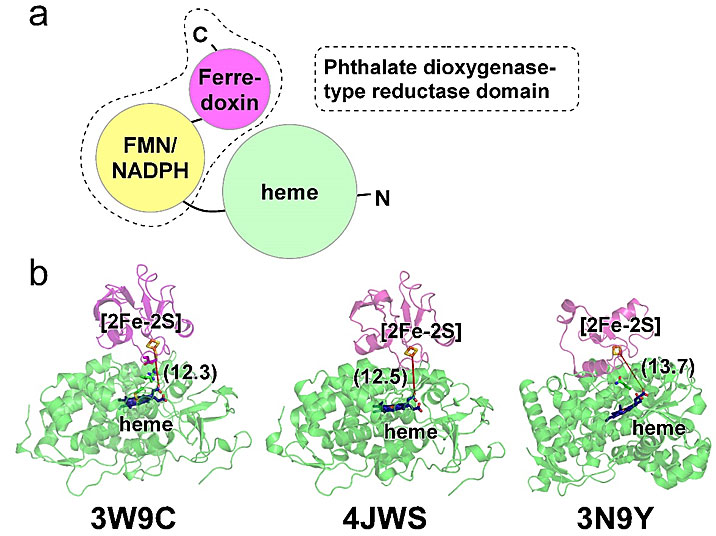
图2. 第二类自给自足P450酶结构域排列 (a) CYP116结构域分布图;(b) 利用PDR作为电子供体的P450 heme结合域与铁氧还蛋白复合体结构。左与中: P450-cam与假单胞氧还蛋白; 右: CYP11A1与皮质铁氧还蛋白。绿色区域为heme结合域,粉色区域为 [2Fe-2S] 结合域,红色虚线标示 [2Fe-2S] 与heme之间的直线距离,括号内为长度 (单位,Å),所有结合在蛋白质中的辅酶以棒状模型表示。
为了研究自给自足P450酶电子传递的机理,作者解析了来源于T. thermophilus的 CYP116B46全长的晶体结构,且建立了清晰的蛋白质模型。结构显示一条连续性的多肽折叠成三个结构域,由两段连接肽相连 (linker 1,linker 2),从氮端到碳端依序为: heme结合域、还原酶结构域和铁氧还蛋白结构域,分别结合heme、FMN和 [2Fe-2S] (图3)。
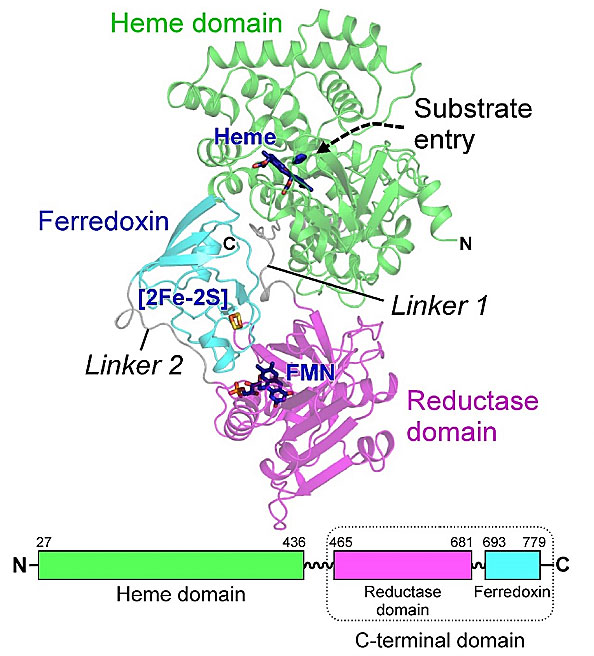
图3. CYP116B46整体结构图 (上) 三个结构域分别由Linker 1和Linker 2连接,氮端(N)、碳端 (C)和结合的配体都分别在图上标出;(下) 三个结构域分别对应的氨基酸编号。
CYP116B46三个结构域的排列与电子传递的方向一致 (NADPH→FMN→[2Fe-2S]→heme),heme结合域的底物结合区朝向外,有利于底物进入结合,这些显示了结构的排列合理 (图4a)。其中,FMN和 [2Fe-2S] 的直线距离为7.9 Å,有利于电子的直接传递。另一方面,[2Fe-2S] 和heme的直线距离达 25.3 Å,超过目前认定的有效直接电子传递距离。在这两个氧化还原中心之间由其他辅助因子来帮助电子传送的可能性较低,因为结构显示 [2Fe-2S] 与 heme之间的通道狭窄,缺乏结合其他辅因子的特征。另一方面,氨基酸也是一种电子的载体,所以 [2Fe-2S] 与heme之间的氨基酸可能在电子传送的过程中扮演角色 (图4b)。

图4. CYP116B46分子内电子传递途径 (a) 粗箭头代表电子传递的方向,虚线箭头代表底物 (substrate) 进入活性口袋的方向,三个氧化还原中心之间的虚线与括号内的数值标示着它们之间的直线距离 (单位, Å);(b) FMN C8上的甲基到 [2Fe-2S] 的Fe2之间的传递通路由虚线表示,[2Fe-2S] 和heme之间可能涉及电子传递的氨基酸也被标记出来,主链和侧链都可能参与输送电子的氨基酸则用星号标记,氨基酸用棒状模型表示,而他们的主链用球形模型标记。
为了分析这些氨基酸的侧链基团对于CYP116B46酶活的影响,这些位点分别被突变成丙氨酸,并进行产物生成量的测定来评估每个氨基酸扮演的角色。酶活测试结果显示R388、R718、E723、S726和E729的丙氨酸突变体活性明显下降 (图5a),将这些位点再次标定在结构上,可以看出大致的电子传递方向 (图5b)。R378A突变体蛋白质缺乏血红素造成的红色,一氧化碳处理后也没有出现吸收峰带移的现象,加上R378的所在位置邻近血红素,推测R378可能与结合血红素相关,因此R378A的突变造成的效应更加复杂,需要进一步实验才能判断此一位点对于CYP116B46电子传递的影响。
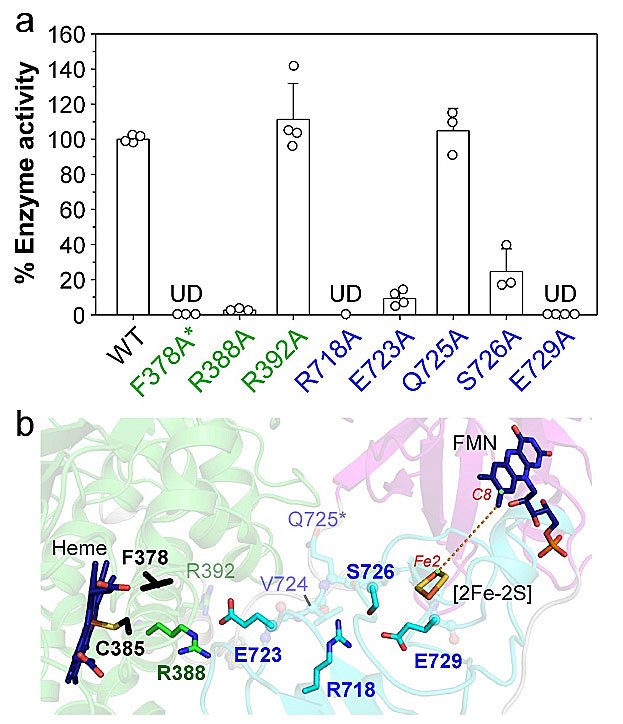
图5. [2Fe-2S] 与heme通道的氨基酸突变验证 (a) 野生型 (WT) 与各CYP116B46突变的重组蛋白质的活性。以野生型作为百分之百,其他突变的百分比以平均值+标准偏差显示,每一个用来计算平均值的单一数值以圆圈表示。UD,undetectable。*,R378不带有血红素也无活性。(b) 同图4b,侧链突变后活性下降的氨基酸突出标记。
整体来讲,本论文报道了几十年来第一个自我供给电子的P450全长的三维结构,结构域的排列吻合电子传递方向,表明电子从FMN 通过 [2Fe-2S] 到 heme是一个合理的通路。此一P450酶的全长结构的报导,对于了解自给自足P450酶催化机理是一个重要的里程碑,对于P450酶改造与应用更具有重要的指导意义。
湖北大学生命科学学院、省部共建生物催化与酶工程国家重点实验室张丽兰 (博士后)、谢珍珍 (“十年树人”硕士研究生)和刘紫薇 (“十年树人”四年级本科生) 为本文的共同第一作者 (图6)。

图6. 研究成果出自于湖北大学省部共建生物催化与酶工程国家重点实验室的结构生物学研究中心。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Structural insight into the electron transfer pathway of a self-sufficient P450 monooxygenase
Lilan Zhang, Zhenzhen Xie, Ziwei Liu, Shuyu Zhou, Lixin Ma, Weidong Liu, Jian-Wen Huang, Tzu-Ping Ko, Xiuqin Li, Yuechan Hu, Jian Min, Xuejing Yu, Rey-Ting Guo, Chun-Chi Chen
Nat. Commun., 2020, 11, 2676, DOI: 10.1038/s41467-020-16500-5
导师介绍
陈纯琪
https://www.x-mol.com/university/faculty/188075
马立新
https://www.x-mol.com/university/faculty/179915
郭瑞庭
https://www.x-mol.com/university/faculty/43015
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号