Science:缩短57步!bryostatin 3的简洁全合成
Bryostatins(草苔虫素)是从海洋生物草苔虫Bugula neritina中分离得到的一类结构复杂的大环内酯类天然产物(Nature, 1970, 227, 962–963; J. Am. Chem. Soc., 1982, 104, 6846–6848),迄今为止,家族成员共有21个。这类化合物具有潜在的抗癌、免疫增强、诱导突触产生和抗HIV等多种生物活性,最近研究发现它们对中风后遗症治疗和外伤性冲击伤患者血脑屏障恢复也是有益的。尽管确切的机理目前尚不明确,但科学家们已经发现它们对蛋白激酶C(PKC)有很强的亲和性(低纳摩尔级)。然而,bryostatins的自然含量极低,这不仅造成其价格昂贵(166−250 $/10 μg),也极大地限制了后续的构效关系研究。基于它们潜在的药用价值和超级复杂的结构特征,近30年来,无数合成化学家前仆后继地围绕其全合成贡献了他们的智慧。即便如此,截止目前也仅有9个课题组实现了其中7个成员的全合成:bryostatin 1 (Keck, J. Am. Chem. Soc., 2011, 133, 744–747; Wender, Science, 2017, 358, 218–223)、bryostatin 2 (Evans, J. Am. Chem. Soc., 1999, 121, 7540–7552)、bryostatin 3 (Yamamura, Angew. Chem. Int. Ed., 2000, 39, 2290–2294)、bryostatin 7 (Masamune, J. Am. Chem. Soc., 1990, 112, 7407–7408; Krische, J. Am. Chem. Soc., 2011, 133, 13876–13879)、bryostatin 8 (Song, Angew. Chem. Int. Ed., 2018, 57, 942–946)、bryostatin 9 (Wender, J. Am. Chem. Soc., 2011, 133, 9228–9231)和bryostatin 16 (Trost, Nature, 2008, 456, 485–488)。

实现全合成的bryostatins类化合物。图片来源:Science
相较于已发现的其他家族成员,bryostatin 3的结构称得上是最复杂,合成挑战也最大。所有bryostatins都含有一个26元内酯大环和三个整合在大环中的高度官能化的四氢吡喃环,而bryostatin 3、19和20还含有直接与大环稠合的第四个环——丁烯酸内酯环(上图bryostatin 3中D环)。这个丁烯酸内酯单元不但增加了结构复杂度,而且对于bryostatin 3与PKC的结合至关重要。到目前为止,只有Yamamura课题组完成了其全合成,但最长线性步骤(longest linear sequence, LLS)为43步,总步骤长达88步,因此实用性非常有限。近日,美国斯坦福大学的Barry M. Trost教授(点击查看介绍)课题组取得了重大突破,将bryostatin 3的全合成路线总步骤缩短至31步,相比之前报道的方法缩短了整整57步,其中最长线性步骤仅为22步,并且反应的原子经济性较高、化学选择性较好。相关结果发表在Science 上。

本文作者团队。其中第一排右三为B. M. Trost教授、第二排右二为Youliang Wang博士(王优良博士现任西安交通大学教授)。图片来源:The Trost Group
研究人员设想的逆合成路线如下图所示:bryostatin 3可通过大环中间体1的二氢吡喃环C的后期氧化官能团化以及钯催化的烯基溴的插羰酯化反应得到,而中间体1可以通过片段2和3的三步转化实现:即钯催化的炔-炔偶联反应来构建C20-C21键、金催化的6-endo-dig环化构建二氢吡喃环C、C1的羧基和C25的羟基经Yamaguchi大环内酯化构筑26元大环内酯。另外,中间体2可以通过片段4和5的两个关键反应得到:即钌催化的烯-炔偶联反应来构筑C12-C13键、C15羟基和原位形成的烯酮发生分子内Michael加成构筑四氢吡喃环B。因此,bryostatin 3的全合成被拆解为三个基本片段3、4、5的合成。

逆合成分析。图片来源:Science
首先,研究人员开始合成片段3。从商品化的原料3-戊烯腈出发,经Sharpless不对称双羟基化反应得到二醇7。随后,用缩酮进行保护得到9,接着用DIBAL-H对氰基进行部分还原制备醛10,后者通过Stork-Wittig烯化反应以较高的收率转化为单一的几何异构体(Z)-烯基碘化物11,接着在钯催化下,与丙炔酸甲酯发生偶联反应得到烯炔酸酯12,且不会改变烯烃的立体化学。12再经过一次Sharpless不对称双羟基化反应便可以优异的收率和中等的非对映选择性完成片段3的合成。
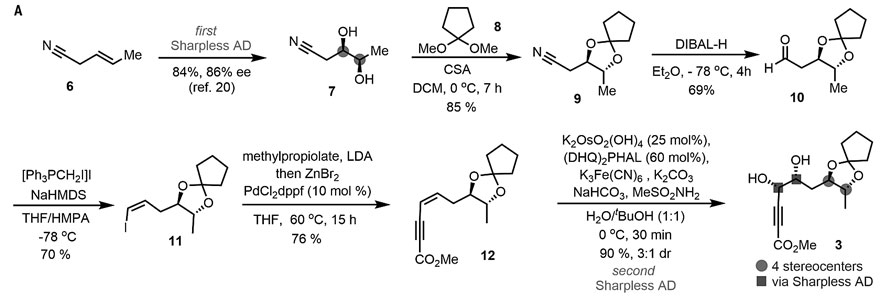
片段3的合成。图片来源:Science
接下来,研究人员着手合成片段4。从3-甲基丁炔13出发,经正丁基锂双锂化后,被N,N'-二甲基甲酰胺(DMF)和三乙基氯硅烷(TESCl)连续淬灭后,以较好的区域选择性和化学选择性得到醛14。随后与烯基溴15衍生的锌试剂发生亲核加成转化为醇16后,在酸性条件下发生消除反应得到不饱和醛17,再与硼酸酯18发生对映选择性的炔丙基化反应就能以优异的收率(86%)和对映选择性(98% ee)完成片段4的合成。而片段5是Krische等人在合成bryostatin 7中所报道过的,此处不再赘述。
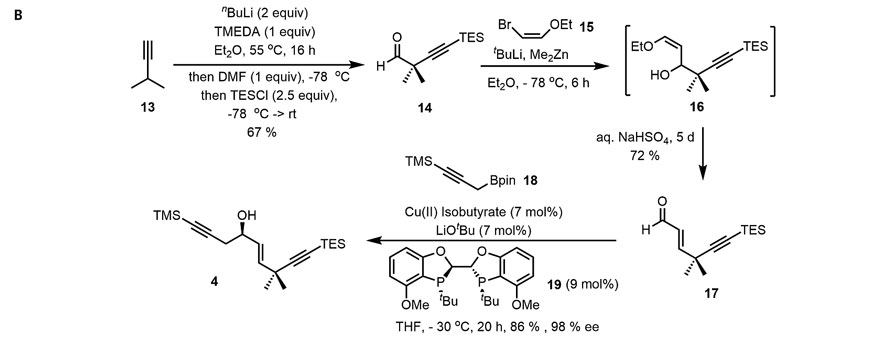
片段4的合成。图片来源:Science
在拿到三个基本片段后,研究人员首先开始制备中间体2。片段4和5通过钌催化的烯-炔偶联反应生成20后,接着发生分子内Michael加成便能以较好的非对映选择性(syn/anti >20/1)转化为四氢吡喃21,尽管分离收率不高(48%),不过好在重现性还可以并且原料还能回收利用;随后用NBS处理将烯基硅21转化为烯基溴22,值得一提的是,该过程的立体化学完全保留,接着在甲醇中用PPTS处理22便可以发生开环酯交换和关环缩酮化得到双四氢吡喃23,再经过硝酸银处理发生脱硅基化反应,便可以87%的分离收率得到中间体2。有意思的是,反应选择性地脱掉TES保护基而不是TBS保护基。
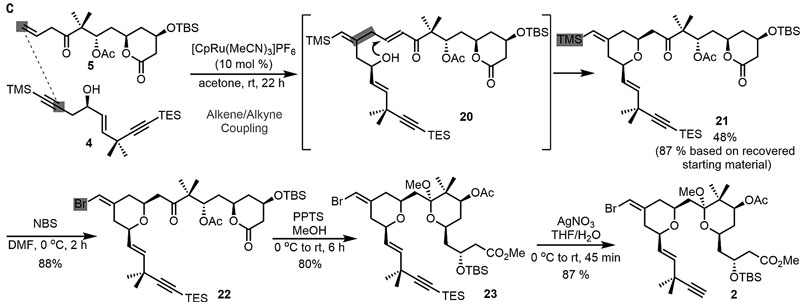
中间体2的合成。图片来源:Science
随后,通过钯催化的炔-炔偶联反应将片段2和3转化为24,后者会自发的通过关环酯化反应生成丁烯酸内酯25。值得注意的是,该反应没有生成六元环内酯,研究人员推测这可能是由环化动力学控制的。随后,向原反应液中加入金催化剂发生6-endo-dig环化反应生成二氢吡喃中间体26,TLC监测反应完全后,向反应混合物中加入ZrCl4的甲醇溶液便可原位进行去缩酮化,重复操作三次就能以48%的总收率得到三醇27。对化合物27的羟基进行选择性保护得到双硅醚28后,在Me3SnOH的作用下选择性地水解甲酯生成酸29(收率80%),然后通过Yamaguchi大环内酯化反应便可以接近定量的收率完成中间体1的合成。
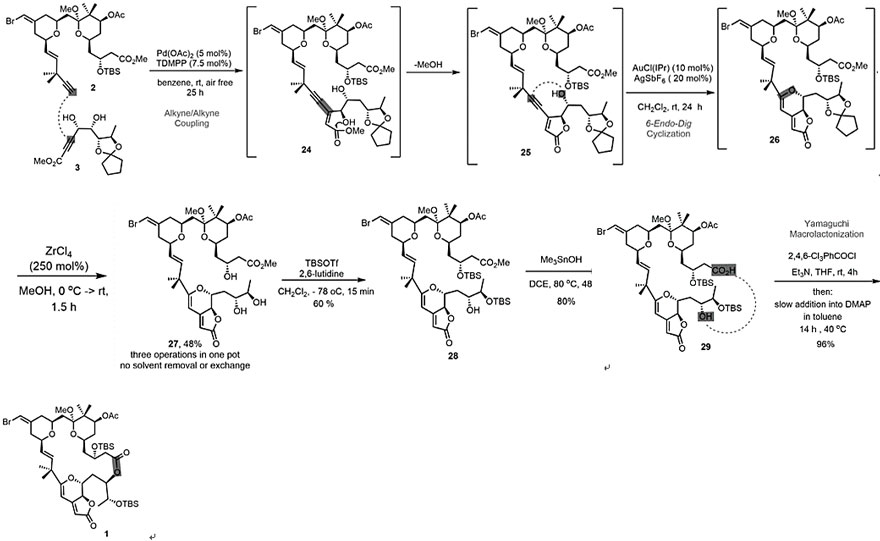
中间体1的合成。图片来源:Science
接下来,研究人员通过二氢吡喃环C的氧化官能团化、B环烯基溴化物的插羰酯化反应以及整体的脱保护来完成bryostatin 3的全合成。首先,中间体1在甲基三氧化铼/过氧化脲(MTO/UHP)的作用下发生化学选择性的环氧化反应得到30,值得注意的是,该反应需要添加1-甲基咪唑以缓冲MTO的Lewis酸性,从而加速反应的进行并延长金属络合物的寿命。尽管NMR监测发现该反应很彻底,但由于环氧化物对酸敏感,后续的纯化过程会导致产率下降。因此,研究人员在简单后处理后直接将粗产品进行甲醇解转化为中间体31,该化合物仍然不稳定,但将其进一步转化为酯33后就可以被分离出来。接着在钯催化剂的作用下,对烯基溴进行插羰酯化反应得到所需的烯基酯34,收率50%。最后,参考Yamamura等人合成bryostatin 3时所采用的“两步法”全局脱保护操作便完成了bryostatin 3的全合成,两步总收率为60%。然而,在做1H-NMR比对的时候遇到问题,后来分析发现文献中所报道的bryostatins这类化合物的氢谱会随浓度而变化。最后,研究人员通过与K. Ohmori等人分离的1 mg bryostatin 3的TLC、1H-NMR、13C-NMR、旋光度和高效液相色谱数据仔细对比后,确认他们合成的化合物正是bryostatin 3。
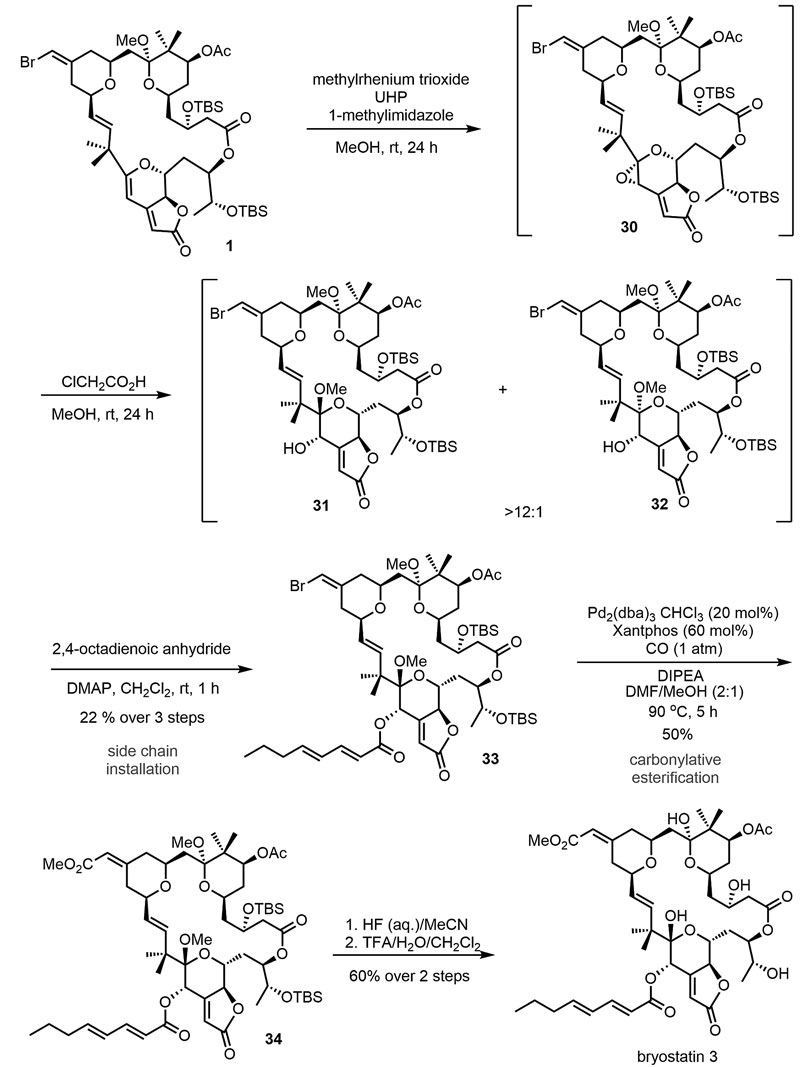
完成bryostatin 3的全合成。图片来源:Science
总结
B. M. Trost课题组将bryostatin 3的复杂结构拆解为三个基本片段,分别合成之后,再通过炔烃偶联反应等将三个主要片段整合在一起,有效的缩减了合成步骤。他们仅以22步的最长线性步骤和总共31步反应路线就实现了bryostatin 3的简洁全合成,并且反应的原子经济性较高、化学选择性较好,对其他bryostatins类化合物的合成也具有重要的借鉴意义。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Total synthesis of bryostatin 3
Barry M. Trost, Youliang Wang, Andreas K. Buckl, Zhongxing Huang, Minh H. Nguyen, Olesya Kuzmina
Science, 2020, 368, 1007-1011, DOI: 10.1126/science.abb7271
王优良教授简介
王优良,博士,西安交通大学“青年拔尖人才”,理学院教授,博士生导师。王优良博士课题组的主要研究方向为有机合成新方法的开发及其在药物、天然产物合成中的应用。目前已在Science, Nature Chemistry, J. Am. Chem. Soc., Angew. Chem. Int. Ed., ACS Catal.等国际知名化学期刊发表论文15篇。
作者介绍
Barry M. Trost
https://www.x-mol.com/university/faculty/433
王优良
http://gr.xjtu.edu.cn/web/youliangwang
https://www.x-mol.com/university/faculty/210266
(本文由峰千朵供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号