北京大学罗佗平课题组实现(-)-Batrachotoxinin A的高效全合成
箭蛙毒素((-)-Batrachotoxin, BTX),是一种从箭毒蛙等物种体内提取的甾体类生物碱,因哥伦比亚的土著居民常用箭毒蛙的毒液制作箭头而得名,是目前已知的毒性最强的非肽类神经毒素之一,它的LD50仅为2 μg/kg,相当于氰化钾的四千分之一。一只箭毒蛙身上的毒素至少能毒死十个成年人,而且无药可解。箭毒蛙毒素可以使受体的神经细胞的钠离子通道保持持续打开,从而导致受体因心力衰竭而死。与此同时,BTX是一种很强的电压门控钠离子通道(Navs)特异性激活剂,对于研究真核细胞离子通道的结构和功能具有极其重要的价值。Navs功能异常与多种疾病都有密切关系,研究BTX与Navs的作用机制有助于促进局部麻醉药、抗心律失常药、抗惊厥药以及癫痫等疾病相关药物的开发。
尽管BTX有着极高的研究价值,但它的获得非常困难。自从1965年首次分离以来,总计牺牲了上万只箭毒蛙,仅分离出约1.2克的BTX及其衍生物。经过多年的研究消耗后,2009年全世界仅剩余不到170毫克BTX,储量非常匮乏。而目前该化合物的唯一来源为天然提取分离,由于人类大量的捕杀,目前箭毒蛙已属受保护的濒危物种,导致BTX的来源更加有限,因此开发一种高效的BTX化学合成方法至关重要。
(-)-Batrachotoxinin A(BTX-A)与BTX具有相同的骨架结构,仅在C20位上氧原子的取代基不同,BTX为取代吡咯酯结构,而BTX-A在C20处为游离羟基,其毒性下降数千倍,可以通过一步酯化反应得到BTX。与一般的甾类化合物不同,该类化合物的C13、C14位之间存在一个额外的氮氧杂七元环,而且AB环之间存在一个跨环的半缩酮结构。整个分子总共包含8个手性中心,其中4个为季碳手性中心,其中合成最大的难度在于C13与C14相邻季碳手性中心的构建。从1965年被分离至今,许多课题组参与了该分子的合成竞争,而且多个课题组研究时间跨度均在十年以上,目前有数十篇文献及博士论文报道了BTX-A的合成研究,其中绝大部分以失败告终,仅有三个课题组完成了BTX-A的合成工作,分别为Imhof课题组(1972年,半合成,大于45步)、Kishi课题组(1998年,首次消旋全合成,45步)、Du Bois课题组(2016年,首次不对称全合成,23步)。
近日,北京大学罗佗平(点击查看介绍)课题组实现了(-)-Batrachotoxinin A的不对称全合成,最长线性步骤为15步,该合成路线是目前合成该类分子最短的路线,相关成果发表在J. Am. Chem. Soc.上。其中2015级博士研究生郭印良为该工作的第一作者,2017级博士研究生郭祉贤对该论文也做出了重要贡献,在将近3年的时间里,他们坚持不懈地探索研究,战胜重重失败与困难,最终实现了该分子的高效合成,极大地解决了该类分子及其衍生物的来源问题。
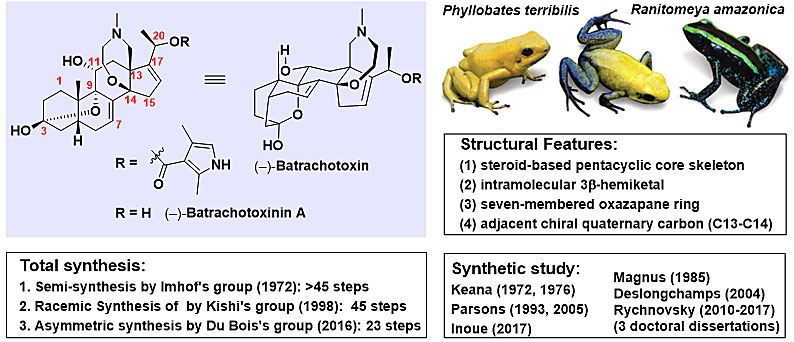
图1. BTX的结构及研究进展
作者的逆合成分析如下(图2),首先,利用中间体3中C17-C20位的双键,通过激发后的单线态氧ene反应,在合成最后期引入batrachotoxin分子中C20位的羟基;5-6并环处的七元内酰胺环,由中间体醛4经过还原胺化、酰化、环化等操作构建,同时C11位的α羟基通过立体选择性还原引入;通过切断关键中间体5中的C18-C21键,引入后期反应所需的双键及醛基;由中间体6通过锂卤交换反应介导的环化反应(局域去对称化策略)构建C8-C14键与C14位季碳手性中心;最优中间体6中的C13位季碳手性中心可以由溴代物7与Cs对称二酮8通过光氧化还原偶联反应来构建。
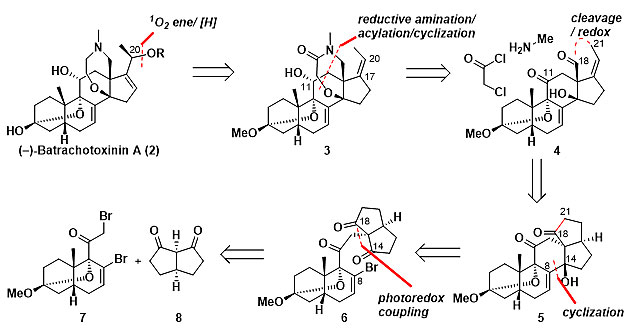
图2. 逆合成分析
具体的合成路线如下(图3):作者通过文献已知的方法制备了化合物9。化合物9与烯基醚锂试剂可以以十克的规模发生亲核进攻、水解反应得到化合物10,后者可经一锅反应,酸催化下形成缩酮结构、再由烯醇硅醚中间体与NBS反应引入羰基α位溴原子,在10克级规模的反应中,能以89%的产率形成α-溴代酮7。然后作者首先尝试从化合物7和8出发,利用简单的烷基化反应(SN2反应)无法构建C13位季碳手性中心,为了解决这一困难,作者采用了罗三中课题组开发的方法学,利用分子间光氧化还原偶联反应构建出这一手性中心(J. Am. Chem. Soc. 2014, 136, 14642)。在光氧化还原催化剂与当量的二胺催化剂协同作用下,能在四克规模的反应中,以70%的产率得到目标产物6。
在得到光反应偶联产物后,C14位手性中心的构建成为了下一个难点。由于C8位烯基溴的空间位阻较大、反应活性低,常用的自由基引发条件以及过渡金属氧化加成条件都不能反应。只有叔丁基锂介导的锂卤交换能够活化这一位点,化合物(+)-6在叔丁基锂的条件下能够以28%的收率得到目标产物(–)-5,同时得到异构体(–)-12(27%)以及脱溴副产物(–)-13(9%)。为了探究此步反应的机理,作者借助DFT计算以及大量的氘代实验,对其反应历程进行了推测(图4),在叔丁基锂的条件下,攫氢反应(叔丁基锂攫取C15与C21位的酸性氢)会优先于卤锂交换反应,即叔丁基锂在反应体系中会先攫取C15位或者C21位的氢原子,分别生成S9与S10两种中间体。由于分子结构中羰基之间的n→π*相互作用以及分子本身极性官能团间的偶极相互作用,使得6-a为优势构象。而通过DFT计算发现,在此优势构象中,C21位要优先于C15被攫氢,因此攫氢反应更容易生成中间体S9,此中间体再发生卤锂交换反应就可得到目标产物5。而S9中间体也可形成半缩酮中间体S9’,此刚性结构再发生卤锂交换反应后无法关闭C环,最后经过后处理得到脱溴的副产物13;副产物13也可由中间体S9或者S10经卤锂交换反应后攫取分子内的酸性氢而生成。攫氢反应生成相对较少的中间体S10再经过卤锂交换后得到副产物12。化合物5可经由烯醇硅醚化得到化合物14,后者可发生双羟化、氧化断裂碳碳键得到化合物16。之后将底物16首先与甲胺缩合得到亚胺,随后在一锅反应加入过量的LiAlH4,发生还原胺化反应同时还原C11位的羰基,得到化合物17,其结构通过单晶得以确证,然而作者发现反应的主产物中C11的立体选择性与目标产物相反。
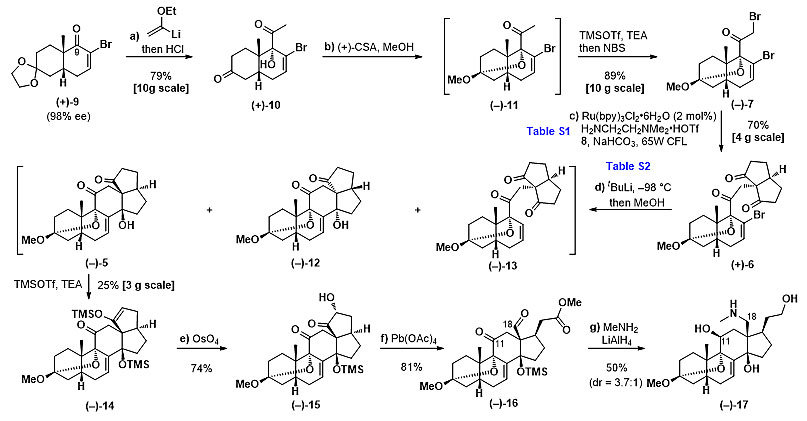
图3. 光氧化还原偶联及局域去对称化操作合成关键合成子(–)-14
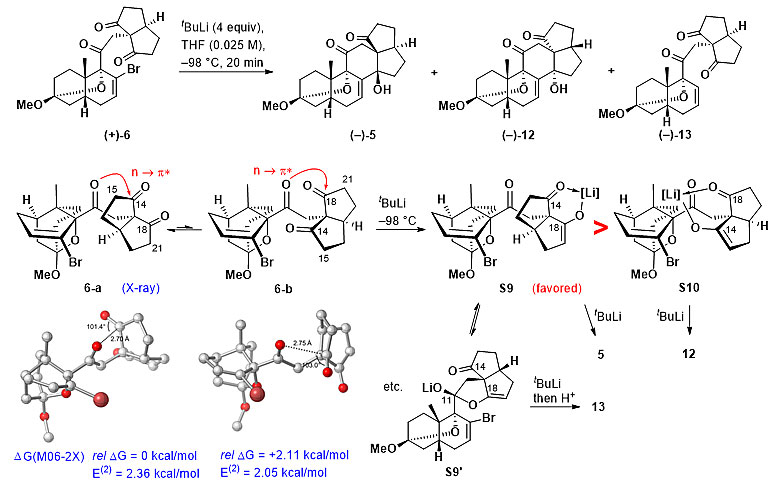
图4. 锂卤交换反应及其反应历程
为了引入C11位正确构型的羟基,作者又设计了新的合成策略来切断五元环(图5),先通过Saegusa氧化在五元环上引入烯酮结构,以90%的收率得到烯酮化合物19,然后在DIBAL-H条件下实现烯酮的1,2-还原,接着在一锅反应中加入过量的LiAlH4,脱除TMS保护基的同时还原C11位羰基,能够以67%的产率得到化合物20,此时可以成功引入C11位正确构型的羟基。然后将底物20中C14位与C18位羟基先经缩丙酮保护后,再在一锅反应中进行臭氧氧化反应,可以分离得到稳定的过氧化合物21,此过氧化合物可被过量的硼氢化钠(20 equiv)于60 ℃下还原得到化合物22。缩丙酮保护、臭氧氧化以及随后的硼氢化钠还原,也可在整合成一锅反应,在克规模的反应中能够以78%的收率得到目标产物22。之后再在酸性条件下发生缩丙酮保护基迁移,再在一锅反应中进行Grieco−Nishizawa反应选择性消除伯醇,在克规模的反应中能够以84%收率得到化合物23。
之后化合物23在酸性条件下脱除丙叉保护基,再在一锅反应中加入高碘酸钠,氧化切断邻二醇,能以53%的产率(回收产率为67%)得到化合物25。对于克规模的反应,为了将大量化合物停留在较稳定的中间体24,采用分步反应的方式合成化合物25。随后作者采用单线态氧ene反应并原位加醋酸酐/吡啶,将末端双键氧化得到烯醛结构,以61%的收率得到产物26,同时得到19%原料被酰化的产物S7,此化合物也可在上述单线态氧反应条件下转化至化合物26。最后采用甲基格氏试剂对烯醛发生1,2-加成反应,再在一锅反应中加入过量的LiAlH4还原酰胺、脱除乙酰基、最后再酸化脱除甲氧基保护基,即可实现天然产物BTX-A的不对称全合成,总收率为61%(dr值为6:1)。也可在甲基格氏试剂对烯醛1,2-加成后,将两种差向异构体通过快速硅胶柱进行分离纯化,然后再在LiAlH4/四氢呋喃加热回流的反应条件下还原酰胺并脱除乙酰基保护基,再在反应体系中加入盐酸脱除甲氧基,能够以89%的收率得到构型单一的天然产物BTX-A。
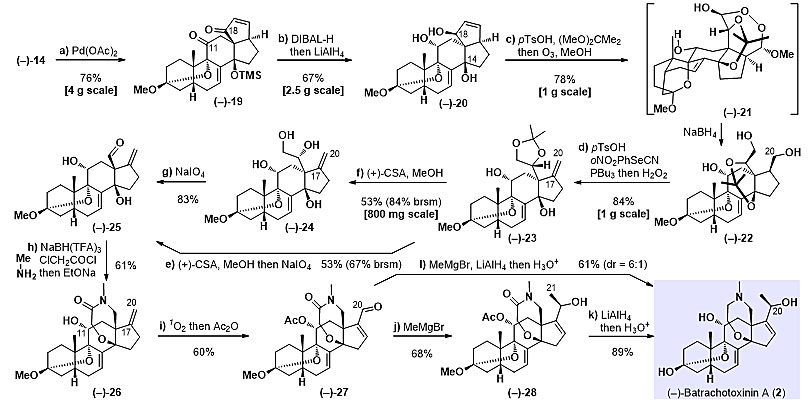
图5. (–)-Batrachotoxinin A (2)的全合成
另外,天然产物全合成的规模化通常会存在许多困难,包括路线长度、总产率、试剂成本、反应规模的限制、仪器设备的要求等等。罗佗平课题组BTX-A的合成路线不仅高效,而且利用的大部分反应具有条件温和、官能团兼容性高的特点,其中许多步骤的产物可以不经过分离纯化直接用于下一步。此外,大部分反应对规模及仪器设备的限制不大,截止到论文发表时,倒数第五步之前的反应均已实现了克规模以上的制备,而且路线中最关键的光氧化还原偶联只需要使用最普通的日光灯作为光源即可反应。
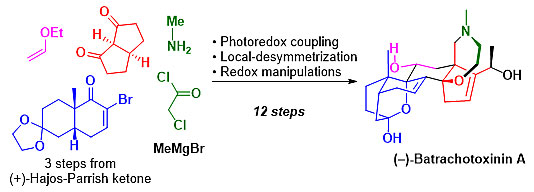
图6. 基于光氧化还原偶联/局域去对称化的合成策略实现BTX-A的高效不对称全合成
总而言之,作者从Hajos-Parrish酮出发,基于光氧化还原偶联/局域去对称化的合成策略,开发出一条高效实用的不对称全合成路线,最初线性步骤为15步。不仅大大缩短了前人的合成路线,而且在合成后期的中间体也可进行克规模的制备。该工作不仅极大地解决了BTX的来源问题,为进一步的钠离子通道研究提供了有力的支持,而且为高氧化态甾类化合物的合成策略提供了新的思路。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Total Synthesis of (−)-Batrachotoxinin A: A Local-Desymmetrization Approach
Yinliang Guo, Zhixian Guo, Jia-Tian Lu, Runting Fang, Si-Cong Chen, Tuoping Luo*
J. Am. Chem. Soc., 2020, 142, 3675−3679, DOI: 10.1021/jacs.9b12882
导师介绍
罗佗平
https://www.x-mol.com/university/faculty/8710
课题组主页
http://www.chem.pku.edu.cn/luotp/
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!









































 京公网安备 11010802027423号
京公网安备 11010802027423号