Sci. Adv.:南佛罗里达大学蔡健峰和Scripps沈卫军团队报道新型GLP-1拟肽
胰高血糖素样肽1受体(GLP-1R)属于GPCR的B类家族,其肠降血糖素螺旋肽配体GLP-1类似物有望成为治疗2型糖尿病和肥胖症的候选药物。然而,由于蛋白酶的快速降解,GLP-1的半衰期非常短。稳定GLP-1在开发治疗糖尿病的药物中至关重要。侧链交联策略已用于GLP-1的构象和代谢稳定化。但是,交联链和GLP-1R之间可能会发生意料之外的接触,并且蛋白水解稳定化的程度可能会受到限制。可以想象,螺旋折叠剂可以作为替代策略来开发蛋白水解稳定的GLP-1R激动剂。Gellman等人报道了用构象约束的β-氨基酸残基替代某些天然α残基来模拟内源性GLP-1的工作。经过合理设计的α/β肽在体内显示出有效且延长的活性。Goudreau等人最近报道了在GLP-1序列中使用寡聚尿素部分来改善GLP-1的药物特性。Levine等人使用O-GlcNAcylation来修饰GLP-1,从而提高了稳定性和体内活性。然而,尚无关于使用整个非天然骨架模拟GLP-1的报道。由于α-螺旋和螺旋折叠子之间的螺旋度差异,非自然的拟肽模拟长α-螺旋具有很高的挑战性,但由于完整的非天然主链比杂化的肽更能抵抗蛋白水解,因此具有吸引力。
近年来由南佛罗里达大学蔡健峰团队开发的Sulfono-γ-AApeptides作为一类新型的螺旋模拟物,在解决在破坏α-螺旋介导的蛋白质-蛋白质相互作用中的开始崭露头角。作为完全对蛋白水解稳定的拟肽,Sulfono-γ-AApeptides表现出与众不同的折叠方式。值得注意的是,一半的残基是由磺酰氯引入Sulfono-γ-AApeptides中的(图1A),提供了巨大的化学多样性。此外,均相Sulfono-γ-AApeptides的单晶显示其侧官能团的精确3D排列和螺旋间距(α-螺旋的螺距为5.1Å,Sulfono-γ-AApeptides的螺距为5.4Å),从而可以开发各种α的螺旋模拟物来破坏蛋白质-蛋白质之间的相互作用(图1B-C)。作者对这种α-螺旋模拟策略是否可用于模拟非常长的螺旋肽GLP-1很感兴趣。在功能上,尚不清楚是否可以通过基于Sulfono-γ-AApeptides的螺旋折叠剂来模拟天然GLP-1以形成有效的GLP-1R激动剂。天然GLP-1中的关键残基能否在Sulfono-γ-AApeptides中仍然起重要作用?Sulfono-γ-AApeptides的整体螺旋结构相对于杂化的肽在与GLP-1R相互作用时,可能会引起其他问题。如果不模拟GLP-1的确切结构,Sulfono-γ-AApeptides是否能够模拟GLP-1螺旋的多个面上的残基?如果成功,这将为开发具有不同化学官能团的Sulfono-γ-AApeptides GLP-1R激动剂提供一般策略。这种模拟α-螺旋的方式将为模拟无数的长而复杂的螺旋肽提供新的范例。在本文中,作为概念证明,该团队和Scripps研究所沈卫军教授团队联合报道了模拟GLP-1的具有完整非天然残基的折叠型拟肽的第一个实例。

图1. Sulfono-γ-AApeptides的化学和晶体结构. A. Sulfono-γ-AApeptides的化学结构. a和b 分别表示building block 的手性侧链和sulfonamido 侧链. B. Sulfono-γ-AApeptide的晶体结构; C. B的俯视图。D-E. sulfono-γ-AApeptides的侧链分布示意图。D. 侧视图; E. 俯视图。
对GLP-1 / GLP-1R相互作用的分析显示,GLP-1上的关键残基与GLP-1R的紧密结合。简而言之,GLP-1与其N末端结构域和C末端结构域同时参与以与GLP-1R相互作用(图2A)。在N末端结构域中,极性残基H7,E9,T11,T13和S17与受体的7个跨膜结构域(7TMD)的相互作用最为关键(图2B)。截短的N末端域GLP-1肽衍生物在cAMP分析中是nM浓度的GLP-1R的激动剂。有趣的是,有时此类N末端截短会导致GLP-1R拮抗剂如GLP-1(9-36)和exendin(9-39)。相反,疏水残基F28和L32主导了GLP-1的C端α-螺旋与GLP-1R的胞外域(ECD)的相互作用。有趣的是,Cryo-TEM研究表明,整个GLP-1肽形成了相当笔直的α-螺旋而不是G22扭结的螺旋,这表明G22的扭结可能是由于晶体堆积造成的,减轻了同时模拟GLP-1的N和C末端域的挑战。实际上,仔细观察GLP-1上的关键残基(图2B和2C)显示,H7和T11在螺旋的同一面(X)上,而F28和L32在Y面;E9,T13和T11位于面Z上(任意指定X,Y,Z)。
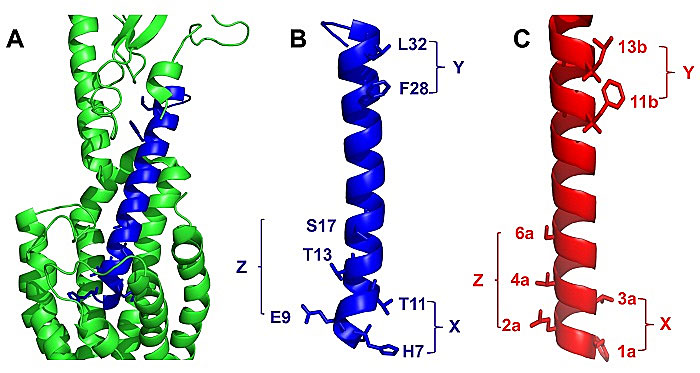
图2. 结构分析。A. GLP-1与GLP-1受体的作用示意图 (PDB: 5VAI)。GLP-1 (7-36)用蓝色表示,GLP-1受体用绿色表示。B. GLP-1的螺旋结构域,其关键性残基用棍状表示。C. sulfono-γ-AApeptide 3的设计。
作者根据这些初步的分析设计了可能模拟GLP-1的螺旋sulfono-γ-AApeptides。如图1D-E所示,手性侧链和磺酰基侧完美地分布在螺旋支架的四个面上,可用于模拟与GLP-1R相互作用的天然GLP-1螺旋结构域的关键残基。进一步的比较表明,侧链1a和3a可以模仿GLP-1的X面上的残基,11b和13b可能会复制GLP-1的Y面上的残基的功能。作者进一步推测,2a,4a和6a可以捕获 E9,T13和S17的功能。基于这种设计策略,作者对sulfono-γ-AApeptides进行了合成。
小结
作者在此报道了一系列螺旋的sulfono-γ-AApeptides,它们可以在结构和功能上模拟GLP-1 α-螺旋结构域多个面上的残基。这些非天然螺旋拟肽在cell-based assay和oral glucose tolerance test中显示出强效的GLP-1R激动活性。这项工作代表了首例基于模拟GLP-1的具有完全非天然骨架的foldameric拟肽。这些螺旋的sulfono-γ-AApeptides具有出色的蛋白水解稳定性,从而增强了它们在生物学上应用的潜力。基于α-螺旋模拟的sulfono-γ-AApeptides为开发新的抗糖尿病GLP-1R激动剂提供了一种范例。
该工作最近在Science Advances 在线发表,南佛罗里达大学桑鹏博士和Scripps研究所的Zhihong Zhou博士为文章的共同第一作者,南佛罗里达大学蔡健峰教授和Scripps研究所沈卫军教授为文章的共同通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

The activity of sulfono-γ-AApeptide helical foldamers that mimic GLP-1
Peng Sang, Zhihong Zhou, Yan Shi, Candy Lee, Zaid Amso, David Huang, Timothy Odom, Vân T.B. Nguyen-Tran, Weijun Shen,* Jianfeng Cai*
Sci. Adv., 2020, 6, eaaz4988, DOI: 10.1126/sciadv.aaz4988
导师介绍
蔡健峰
https://www.x-mol.com/university/faculty/47852
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号