南方科技大学刘心元课题组Nature Catal.:铜/手性磷酸催化的消旋三级碳氢键的立体汇聚式不对称胺化反应
有机分子中碳氢键的直接对映选择性官能化反应,具有原子经济性和步骤简洁性等特性,成为构建碳手性中心的理想方法。近年来,过渡金属催化的碳氢键不对称反应得到了快速发展,代表性的策略主要包括过渡金属催化的碳氢键活化、金属卡宾/氮宾(Nitrene,也作“乃春”)参与的协同碳氢键插入反应(图1a),以及利用攫氢/自由基快速捕获方法实现分步的碳氢键插入反应(图1b)。然而,目前发展的这些方法一般只适用于前手性碳氢键的不对称官能团化。针对普遍存在的外消旋的三级碳氢键,利用不对称催化实现其立体汇聚式不对称官能团化反应合成手性季碳化合物,目前仍缺少有效方法(图1c)。
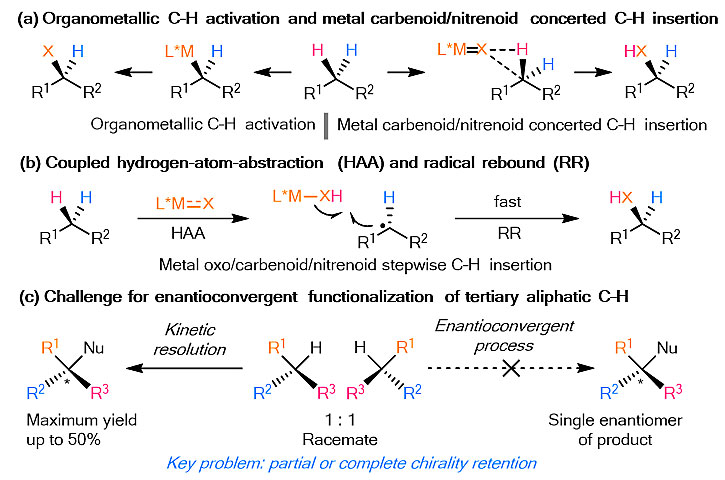
图1. 过渡金属催化的碳氢键不对称官能化反应。图片来源:Nat. Catal.
南方科技大学刘心元(点击查看介绍)课题组设计并发展了基于铜/手性抗衡离子或阴离子配体的单电子转移催化体系,实现了一系列自由基参与的不对称催化反应(Acc. Chem. Res., 2020, 53, 170; Nat. Chem., 2019, 11, 1158; Nat. Catal., 2020, 3, 401; J. Am. Chem. Soc., 2020, DOI: 10.1021/jacs.0c03130; Chem, 2020, DOI: 10.1016/j.chempr.2020.03.024)。近期,该课题组利用一价铜/手性磷酸(CPA)协同催化体系,成功实现了苄位/烯丙位C(sp3)-H分子内不对称胺化反应(Angew. Chem. Int. Ed., 2020, 59, 1129)(图2a)。在这些工作的基础上,为了解决金属催化的外消旋的三级碳氢键的立体汇聚式不对称官能团化挑战性课题,最近刘心元课题组发展了铜/手性磷酸作为单电子转移催化剂,利用消旋的酮类化合物与磺酰肼缩合,通过中间体I成功实现了消旋三级碳氢键的立体汇聚式不对称胺化反应,得到一系列二氢吡唑衍生物,然后通过多样性转化高效构建了1,3-二胺和双季碳环丙烷等手性骨架(图2b)。相关研究成果近日在Nature Catalysis 上在线发表。
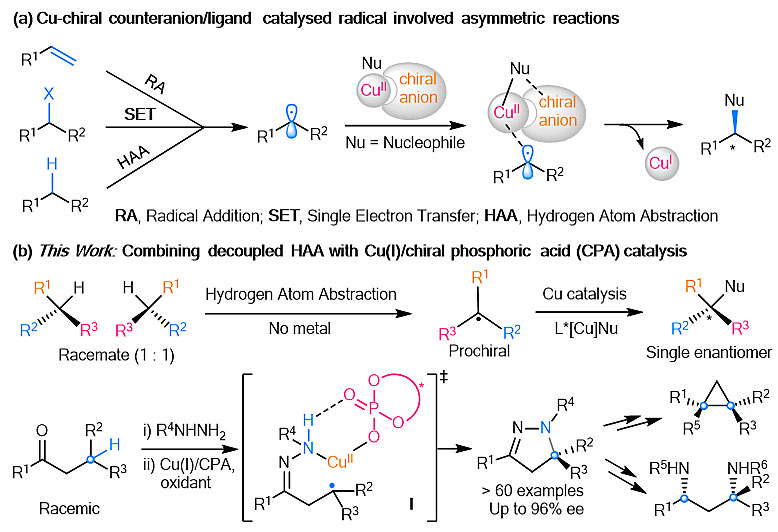
图2. 铜/手性阴离子体系催化的不对称自由基化学。图片来源:Nat. Catal.
作者首先对反应条件进行了优化,并最终确定CuCN (10 mol%) /手性磷酸(R)-C3 (15 mol%) 组成的协同催化体系,以(NH4)2CO3 (5 mol%) 作为添加剂可以取得最好的反应结果。在最优反应条件下,作者考察了反应底物的普适性:对于芳基磺酰腙部分,苯环上不同电性取代基的底物都可以得到预期产物(1-19),其中产物14经单晶衍射测定手性中心的绝对构型为S(图3a)。对于酮底物的取代基,可以是芳基或者杂芳基(20-44),也可以是环己基(45)、叔丁基(46)以及金刚烷基(47)等烷基取代基(图3b),表明该反应具有广泛的底物适用范围。
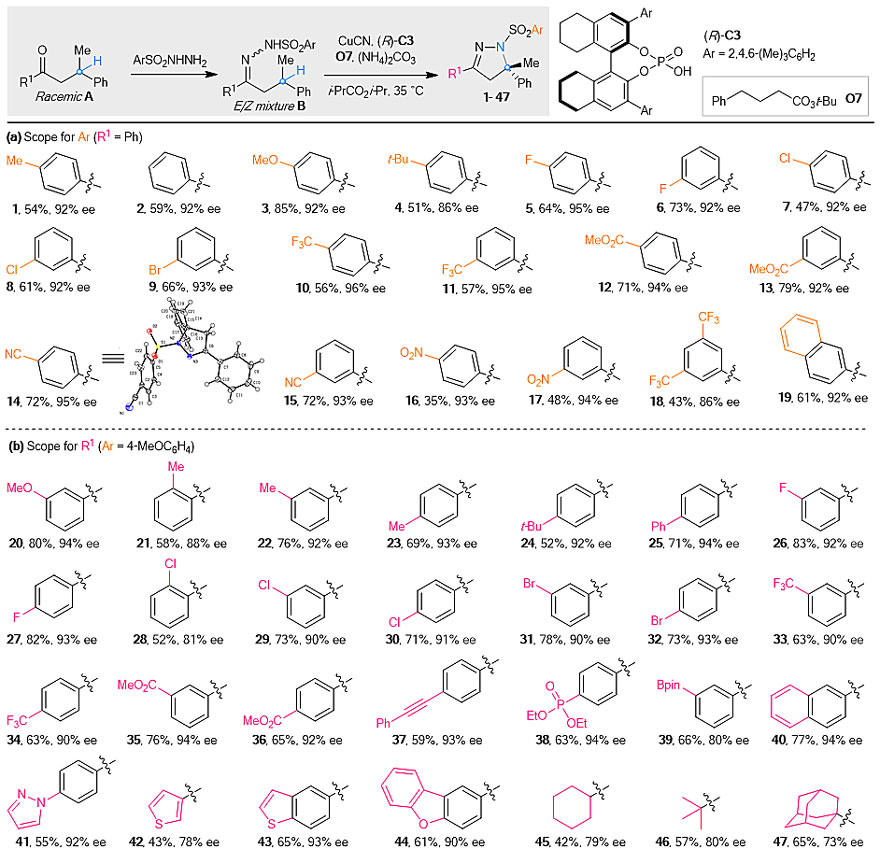
图3. 底物适用范围考察。图片来源:Nat. Catal.
作者接下来对季碳手性中心的取代类型进行了重点考察。结果表明,虽然目前反应底物中三级C(sp3)-H的芳基是必需的,但是取代的苯基(48)或者噻吩等杂环取代基(49-50)都可以兼容。对于烷基链部分,该立体汇聚式胺化反应显示了很好的官能团耐受性,比如烷基(51-52)、酯基(53-54)、醚(55)、羟基(56)、氯代(57)、叠氮(58)以及烯基(59)取代底物均取得了很好的反应结果。考虑到手性螺环骨架不仅是众多天然产物和药物分子的核心结构,而且为不对称合成中手性催化剂的开发提供了平台,作者随后将该反应策略应用到了手性螺环骨架的构建,实现了一系列不同结构([5,6]-和[5,7]-螺环)以及官能化(碳环、氧杂环、氮杂环和环己烯)手性螺环化合物的高效合成(图4a)。值得注意的是,利用两步“一锅法”直接从消旋的含有三级β-C(sp3)-H的烷基酮出发,同样可以顺利地得到预期产物(图4b)。此外,作者对两种方法都进行了放大量实验,实验结果与标准反应基本一致(图4c-d)。为了证明反应的实用性,作者对反应产物进行了多样性转化,可以合成一系列含有手性季碳中心的吡唑衍生物、手性1,3-二胺(图4e)以及手性双季碳环丙烷化合物(图4f)。
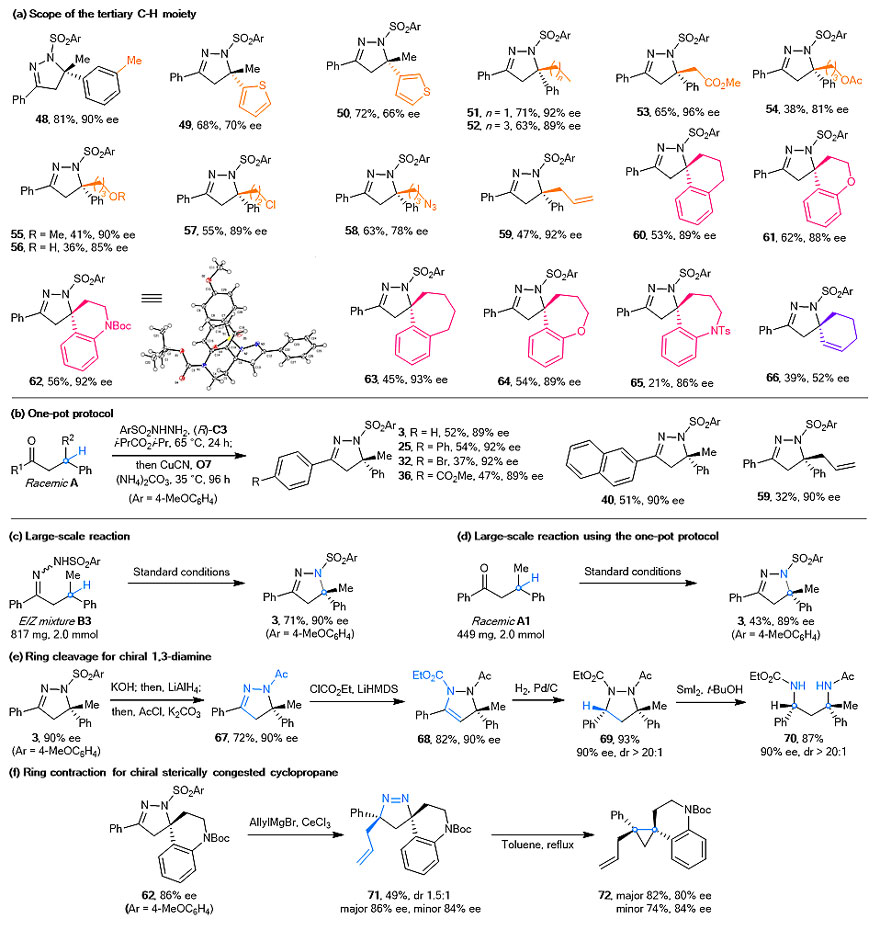
图4. 季碳手性中心的构建及产物的多样性转化。图片来源:Nat. Catal.
机理研究表明反应经历了自由基历程,并且作者利用实验证明反应中涉及1,5-氢迁移(HAA)过程生成了前手性的三级烷基自由基物种。作者提出可能的反应机理如下:首先是Cu(I)/CPA协同活化氧化剂产生高活性的自由基物种,接着攫取键能较弱的N-H键生成氮中心自由基,经分子内不可逆的1,5-氢迁移得到前手性的三级碳中心自由基物种,随后结合了氮亲核试剂的手性二价铜捕捉该烷基自由基物种,最终实现了外消旋的三级碳氢键的立体汇聚式不对称胺化反应(图5)。
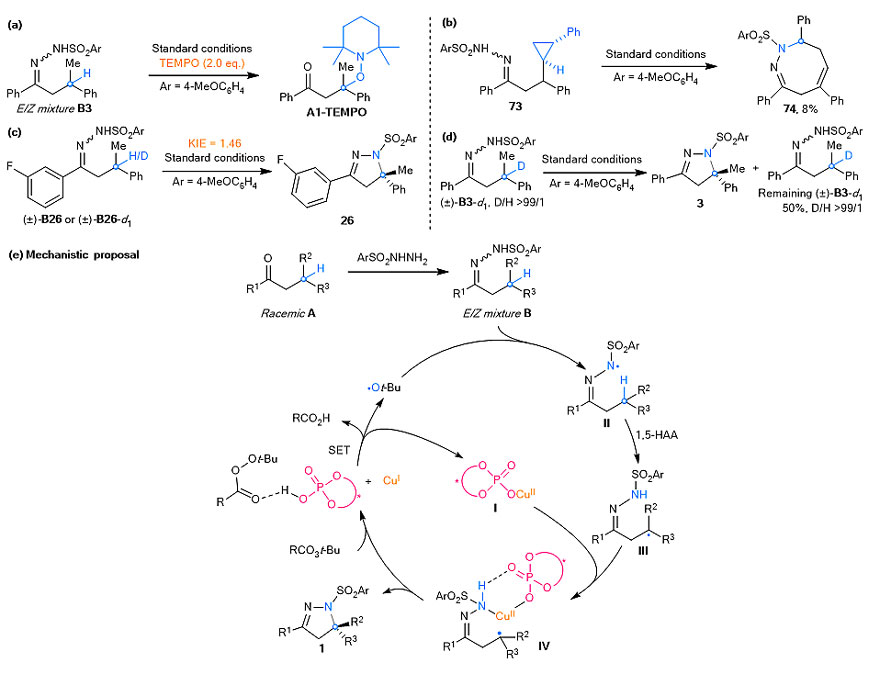
图5. 机理研究和推测的反应机理。图片来源:Nat. Catal.
总结
刘心元课题组利用一价铜/手性磷酸协同催化体系,巧妙地通过分子内氢迁移的方式,将外消旋的三级碳氢键转化为前手性的三级烷基自由基中间体,然后以较慢的速度捕捉手性二价铜的氮亲核试剂,实现了外消旋三级碳氢键的高对映选择性立体汇聚式胺化反应。该反应也可以用两步“一锅法”的方式来实现,合成了一系列含有季碳手性中心的吡唑衍生物,并通过多样性转化高效构建了1,3-二胺和双季碳环丙烷等手性骨架。相关研究成果不仅丰富了铜/手性抗衡离子或阴离子配体的单电子转移催化体系在自由基不对称化学中的应用,而且为发展新的不对称催化模式实现三级碳氢键的立体汇聚式官能化反应提供了新思路。
该课题组所有研究项目都得到了国家自然科学基金委员会、教育部特聘专家、深圳市科创委、深圳市诺贝尔奖科学家实验室等项目的大力资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Cu-catalysed intramolecular radical enantioconvergent tertiary β-C(sp3)–H amination of racemic ketones
Chang-Jiang Yang, Chi Zhang, Qiang-Shuai Gu, Jia-Heng Fang, Xiao-Long Su, Liu Ye, Yan Sun, Yu Tian, Zhong-Liang Li, Xin-Yuan Liu*
Nat. Catal., 2020, DOI: 10.1038/s41929-020-0460-y
导师介绍
刘心元
https://www.x-mol.com/groups/liu_xinyuan
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号