大环抗衡阴离子捕获催化
发展高效、高选择性催化体系一直是合成化学家追求的目标。大环化合物由于固有的受限空腔和强键合能力,被广泛用作反应器促进底物在仿酶空腔中的特异性转化。另一方面,利用大环对“非直接”反应物种的紧密包合,也能实现对反应的干预与调控,藉此发展新型催化体系。这方面的典型代表是基于冠醚的阳离子键合催化,通过对阳离子的高效键合,不仅可以活化配阴离子,加速催化反应,实现相转移催化,甚至立体控制,已经成为一种通用的催化策略,在诸多涉及阴离子中间体的反应中得到了广泛应用。与之相反,基于大环阴离子受体对抗衡阴离子的高效键合,实现阳离子主导反应过程的催化与调控,却未见报道。
近期,中国科学院化学研究所王其强研究员(点击查看介绍)团队,受冠醚阳离子键合催化启发,提出了大环抗衡阴离子捕获催化策略。他们通过设计合成具有强键合能力的大环阴离子受体,利用对酸抗衡阴离子的捕获,在获得显著催化加速效应的同时,通过手性大环空腔引发精准的立体控制,实现了高效高对映选择性的转化。该策略可望提供一种与冠醚阳离子键合催化相平行的策略,实现一系列涉及阳离子中间体反应过程的催化与调控(图1)。相关工作以发表在Angewandte Chemie International Edition 上。
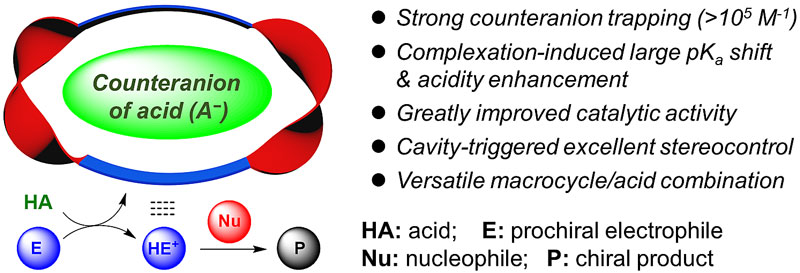
图1. 大环抗衡阴离子捕获催化
王其强研究员团队一直致力于发展高效高选择性的大环协同识别与超分子催化体系,特别是致力于构建功能化缺电性大环体系,以调控阴离子活性与稳定性,发展基于阴离子的高效识别与催化体系。在前期的工作中,他们通过构建具有多重协同键合位点和合适空腔大小的非手性双硫脲大环,利用大环对乙二磺酸抗衡阴离子的捕获(K > 106 M-1),实现了酸催化Povarov反应的巨大加速(Chem. Eur. J., 2018, 24, 4268)。在此基础上,他们设想进一步发展手性大环抗衡阴离子捕获催化,在保持催化加速效应的同时,实现高对映选择性的转化。
基于前期的工作基础,作者通过将两个芳基硫脲与两个手性联二萘酚单元在3,3'-位进行连接,成功设计合成了一系列具有手性骨架和协同键合位点的多功能手性大环M1-M6(图2)。该系列大环合成简便,成环产率均在50%以上,并且通过联二萘酚2,2'-位置上的便利化修饰,能实现大环内部空腔及其手性微环境的多样化调控。
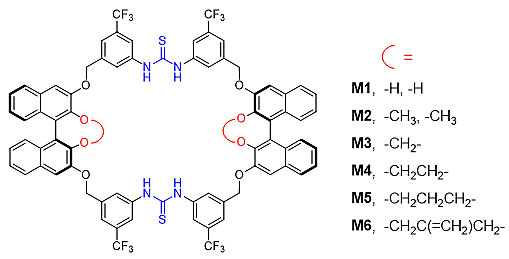
图2. BINOL衍生的手性双硫脲大环结构
键合研究表明,这类大环与乙二磺酸根阴离子能形成非常强的键合,结合常数可达105 M-1。对于大环M5和M6,上述键合在核磁上呈现缓慢交换过程,说明较大的内部取代基会限制阴离子客体在大环空腔中的自由进出。晶体结构及理论计算均表明,乙二磺酸根阴离子被紧密包合在大环空腔之中,两个硫脲基团与之形成多重氢键作用,大环骨架周围多个C-H位点也参与了协同键合,同时对于M6,两侧的双亚甲基乙烯基紧紧钳住乙二磺酸根客体(图3)。通过阴离子键合,大环呈现马鞍状结构,两侧BINOL萘环分别与相连的三氟甲基苯环组成两对鞍面,围成一个峡谷状的手性空间,乙二磺酸根坐落于谷底中间。
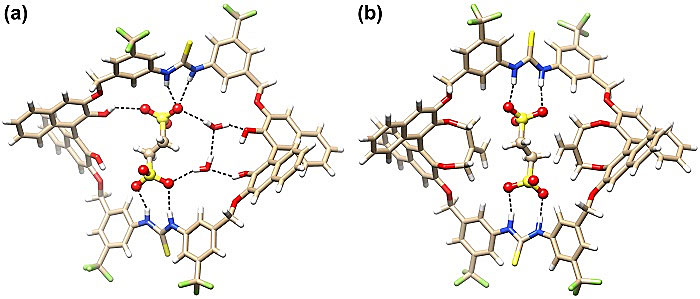
图3. 手性双硫脲大环M1、M6与乙二磺酸根阴离子的复合物结构
上述结果表明这类大环能强烈键合乙二磺酸根阴离子,并形成一个受限的手性空腔微环境。作者将这类大环应用于催化N-苄基吲哚与亚胺底物的不对称傅克反应。他们发现,当与乙二磺酸(EDSA)组合时,在一系列底物的转化中,使用1 mol %的手性大环M6即可取得非常优秀的转化和高达99%的ee值,而同等条件下单独使用大环或乙二磺酸,几乎不会获得任何转化(图4)。在反应条件优化过程中作者发现,使用不同大环和二磺酸的组合,可以获得不同甚至相反的立体选择性,显示手性大环/酸组合可以作为一种超分子手性酸,便利地提供多样化的手性控制。上述反应适用于一系列吲哚和亚胺底物,特别是4-位或7-位卤素取代的吲哚底物,并且在克级量的放大反应中仍然具有同等优异的表现,为合成一系列预官能团化的手性3-吲哚基甲胺类产物提供了一条有效的超分子催化路径。
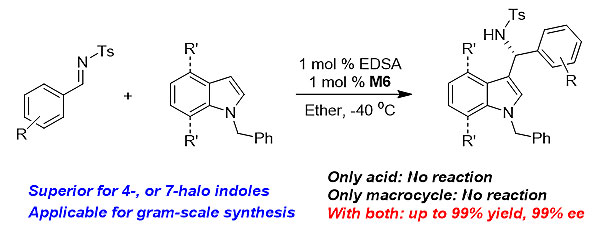
图4. 手性大环/酸催化的对映选择性傅克反应
最后作者对大环加速效应与手性诱导机制进行了考察。控制实验表明,单独大环或乙二磺酸本身并不能有效催化该反应,而使用抗衡阴离子键合较弱的甲磺酸与大环组合时,催化效率与选择性急剧降低(14%产率,28% ee),说明大环与乙二磺酸之间的协同与匹配非常重要。作者随后测定了大环复合诱导的乙二磺酸pKa的变化,发现其累积变化值可达−3.3,显示大环对抗衡阴离子的键合能显著增强乙二磺酸的酸性,这与作者之前报道的酸性增强促进亚胺底物质子化平衡,导致更多反应活性中间体生成这一催化加速机制相一致。
为探究大环的手性诱导机制,作者对大环与乙二磺酸根、质子化亚胺三元复合物的结构进行了DFT计算优化。结果显示,质子化亚胺处于大环复合物空腔的一侧,通过氢键介导的离子对作用与乙二磺酸根键合。大环一侧的联萘和三氟甲基苯环提供多重的C-H∙∙∙π或π∙∙∙π接触,遮挡了亚胺的Re 面,使其Si 面接受吲哚进攻形成预计的R构型产物(图5)。同时,吲哚苄基苯环能与另一侧的萘环形成C-H∙∙∙π作用,并且4,7-位的卤素取代基能提供额外的次级相互作用,进一步稳定了反应过渡态。这表明大环能提供一个良好的手性受限空腔,通过多重的弱相互作用协同实现手性的精准传递与控制。

图5.(a)手性双硫脲大环M6与乙二磺酸根、质子化亚胺三元复合物的DFT优化结构,(b)三元复合物与N-苄基吲哚加成的可能过渡态
上述研究表明,利用大环对酸抗衡阴离子的捕获,在显著增强其酸性、极大加速催化反应的同时,还能利用大环特有的手性空腔实现精准的立体控制。作者认为,大环抗衡阴离子捕获催化,代表了与冠醚阳离子键合催化相平行的策略,拓展了通常的手性酸催化范围,有望发展成为一种通用策略,实现一系列经由阳离子中间体反应的高效高选择性催化。
相关研究结果近期发表在Angewandte Chemie International Edition 上,文章第一作者为中国科学院化学研究所博士研究生宁锐。该项工作得到了国家自然科学基金委和中国科学院的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Chiral Macrocycle-Enabled Counteranion Trapping for Boosting Highly Efficient and Enantioselective Catalysis
Rui Ning, Hao Zhou, Shi-Xin Nie, Yu-Fei Ao, De-Xian Wang, Qi-Qiang Wang*
Angew. Chem. Int. Ed., 2020, DOI: 10.1002/anie.202003673
导师介绍
王其强
https://www.x-mol.com/university/faculty/38315
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号