手性磷酸双功能催化:基于α-烯基取代烯丙基硼酸酯的不对称烯丙基化
大量天然产物及药物活性分子中存在着手性高烯丙醇结构片段。这类手性高烯丙醇化合物一般可以通过对羰基的不对称烯丙基加成反应来构建。和其他类型的烯丙基金属试剂相比,烯丙基硼酸酯毒性低,对水气及氧气比较稳定,因此烯丙基硼酸酯在合成手性高烯丙醇类化合物中的应用越来越广泛。带有手性助剂基团的烯丙基硼酸酯和醛类化合物的不对称烯丙基加成反应是一种合成手性高烯丙醇化合物的常用方法,但是这类反应的缺陷在于需要使用等当量的手性助剂。随着现代手性Lewis酸和Brønsted酸的发展,目前可以通过使用催化量的手性Lewis酸或者Brønsted酸来实现非手性烯丙基硼酸酯和醛类化合物的不对称烯丙基加成反应。合成手性高烯丙醇化合物的另一种策略是使用α-位有取代基的光学纯烯丙基硼酸酯(1)和醛进行不对称烯丙基化反应(图1)。这类反应通过从原手性基团到目标手性基团进行手性转移来实现对手性高烯丙醇的制备,所以烯丙基硼酸酯原料(1)的光学纯度会直接决定产物高烯丙醇的光学纯度。该策略的问题在于这类α-手性取代的烯丙基硼酸酯的高对映选择性制备比较困难,而且当此类烯丙基硼酸酯α-位取代基是非极性基团的时候,反应的选择性不佳。通过对反应的Zimmerman-Traxler过渡态分析可以看到,烯丙基硼酸酯(1)和醛的加成反应会产生一对非对映异构体2 和3。当R基团处于平伏键时(TS-1),反应将得到E-构型产物2;而当R基团处于直立键时(TS-2),反应会形成Z-构型产物3。在通常情况下,反应的非对映选择性非常低。
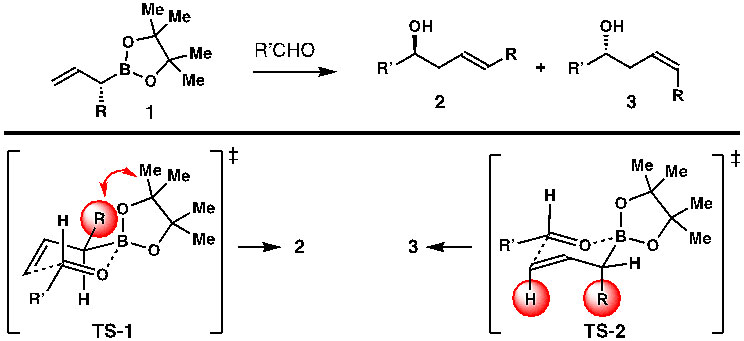
图1. α-位单取代的烯丙基硼酸酯对醛的加成反应
美国奥本大学陈明教授课题组近期设计了一种α-烯基取代的烯丙基硼酸酯(5)来研究不对称烯丙基化反应(图2)。与传统的α-手性取代的烯丙基硼酸酯相比,这种烯丙基硼酸酯(5)没有手性,可以非常方便地由价格低廉的CH2Cl2、B(OMe)3、烯基格氏试剂和1,2-二醇进行制备。在手性Brønsted酸催化下,烯丙基硼酸酯5应该可以对醛进行加成反应,生成绝对构型受手性催化剂控制的高烯丙醇。问题的关键是能否通过单一的催化剂来同时实现对该类反应双键构型的控制。
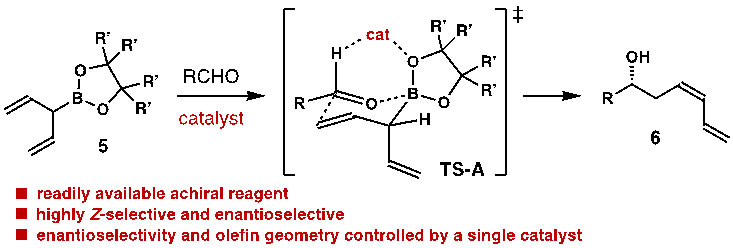
图2. α-烯基取代的烯丙基硼酸酯对醛的加成反应
作者首先制备了非手性的烯丙基硼酸频哪醇酯5a。以5a和苯甲醛为底物,在没有催化剂存在的条件下进行烯丙基加成反应时,反应能够以93%的总收率得到Z/E混合物(Z/E = 1:1)。当以手性磷酸(R)-A作为催化剂时,反应能够以93% ee得到产物6a,但是产物的Z/E比例仅为2:1(图3)。这个结果表明该反应的两个过渡态TS-3和TS-4能量非常接近。
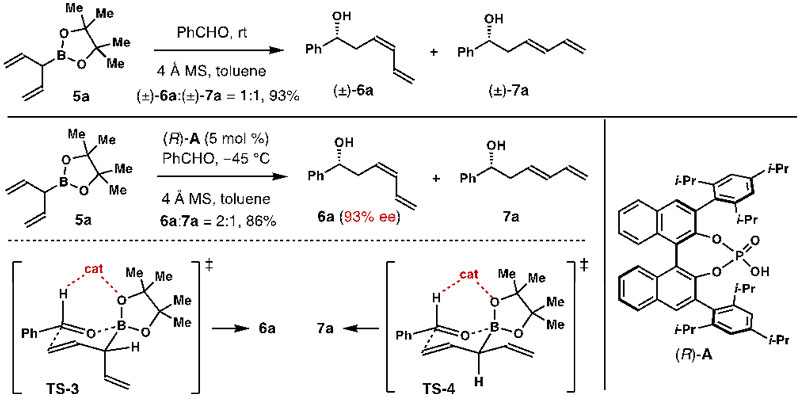
图3. 手性磷酸催化的烯丙基硼酸频哪醇酯5a和苯甲醛的反应
因此,如何提高双键的Z-选择性在这个反应里显得尤为重要。作者在此前的工作中发现,烯丙基硼酸酯中的二醇片段对于烯丙基硼化反应活性以及对映选择性影响很大。作者推测通过调整烯丙基硼酸酯的二醇结构,有可能会改善反应的Z/E选择性。为了验证这个猜想,作者合成了一系列带有不同二醇结构的烯丙基硼酸酯,然后对苯甲醛的不对称烯丙基硼化反应进行了比较(图4)。作者选定手性磷酸(R)-A作为催化剂,当把二醇片段中的R基团从甲基改变为乙基、正丙基、环戊基以及环己基时,反应的Z/E比例都超过了12:1,其中以正丙基的效果最好(5c,Z/E > 30:1)。反应产物的光学纯度也超过了90% ee。此外作者发现,在没有催化剂存在的条件下,5a-h和苯甲醛反应的Z/E选择性都在1:1左右。这表明产物的双键Z-选择性完全由手性磷酸催化剂(R)-A来控制而不是由烯丙基硼酸酯的底物自身来控制。
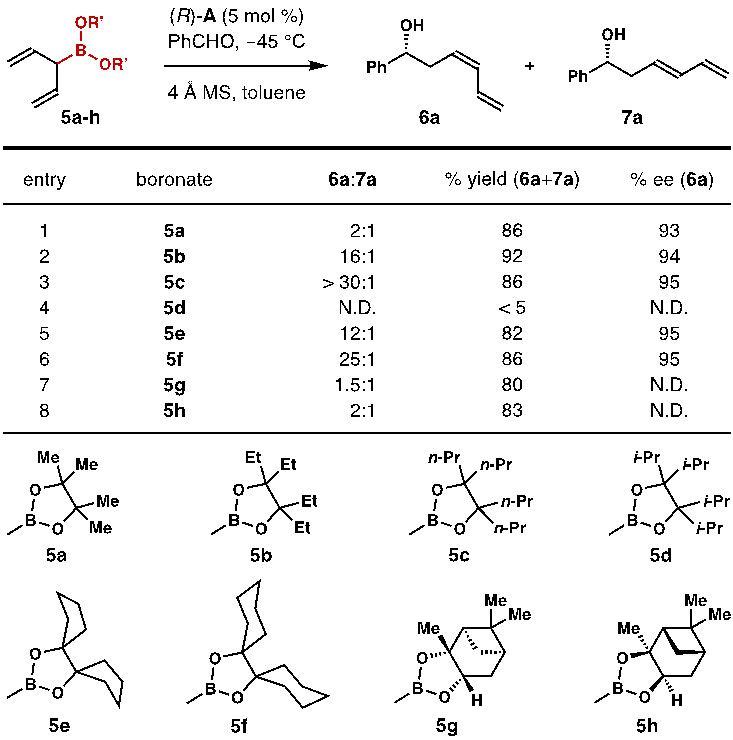
图4. 手性磷酸催化的不对称烯丙基加成反应底物筛选
在获得最佳反应条件后,作者考察了该反应的底物普适性(图5)。该反应对于各类芳香醛、α,β-不饱和醛以及各种饱和脂肪醛均能够以较好的收率,Z/E比例及对映选择性得到目标产物。为了进一步探究反应的底物普适性,作者使用手性醛为底物进行了双立体分化反应研究(图6)。通过手性催化剂及手性醛的组合,反应可以得到9b、9c、10b、10c四个异构体(dr > 30:1, Z/E > 30:1)。此外,为了进一步理解该反应的对映选择性和双键Z-选择性,加州大学洛杉矶分校的Kendall N. Houk教授进行了密度泛函理论计算。计算结果表明,在手性磷酸(R)-A催化条件下,5f的α-乙烯基在反应过渡态中倾向于直立键位置。如果α-位乙烯基在反应过渡态处于平伏键,将会与磷酸(R)-A催化剂骨架中的异丙基距离较近,从而产生位阻使得反应的过渡态能量升高。
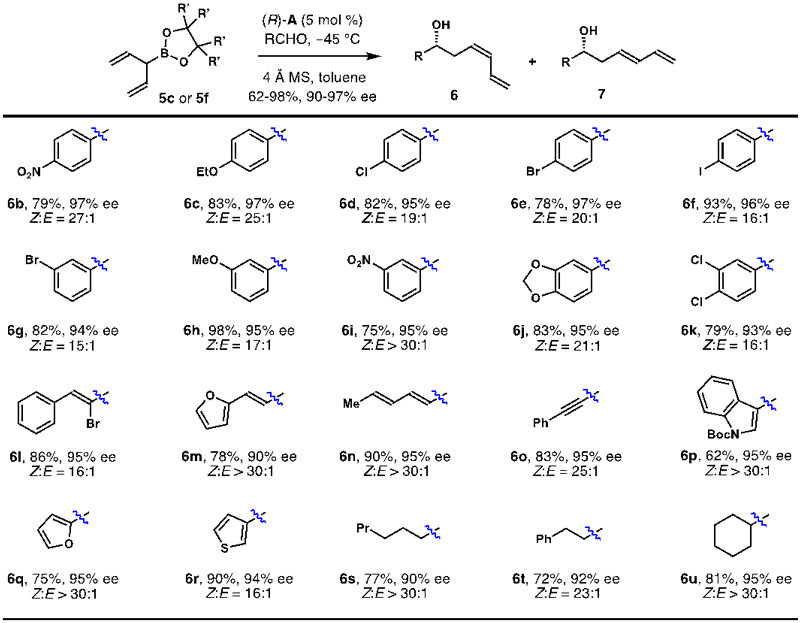
图5. 手性磷酸催化的不对称烯丙基加成反应底物适用性
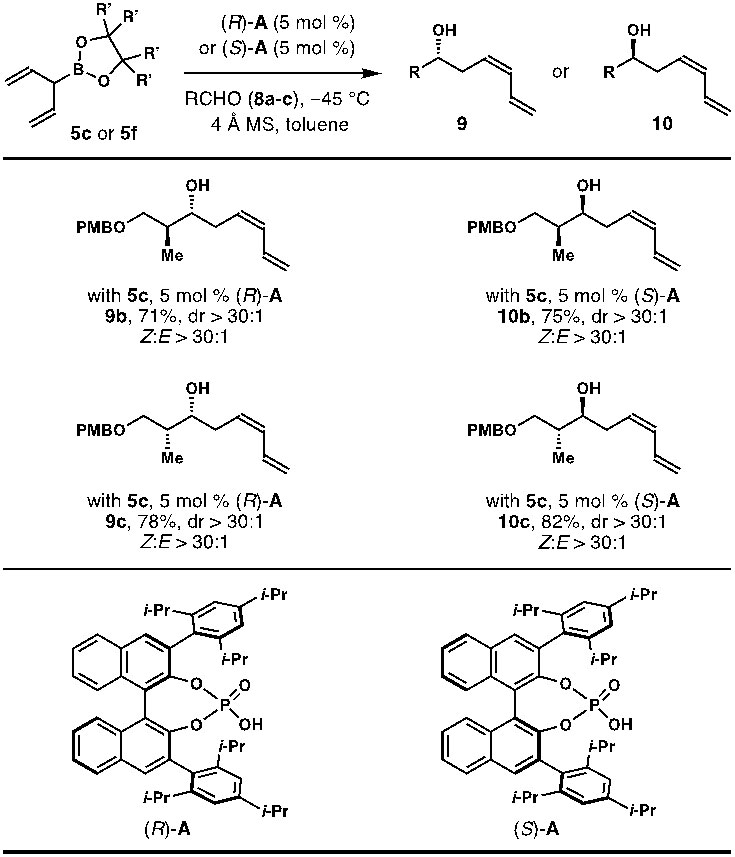
图6. 手性磷酸催化的双立体分化反应
总结
陈明教授课题组在这篇文章设计了一类α-烯基取代的烯丙基硼酸酯。通过对硼酸酯的二醇结构进行改造,手性磷酸催化的不对称烯丙基加成反应可以生成高对映选择性和Z-选择性的手性高烯丙醇。通过DFT计算,作者阐述了反应的手性诱导和Z-选择性的机理。与一般单一功能手性磷酸催化的不对称烯丙基加成反应不同的是,手性磷酸在这个反应中同时起到了控制反应的手性诱导和Z-选择性两种功能。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Chiral Phosphoric Acid Dual-Function Catalysis: Asymmetric Allylation with α-Vinyl Allylboron Reagents
Shang Gao, Meng Duan, Kendall N. Houk, Ming Chen
Angew. Chem. Int. Ed., 2020, DOI: 10.1002/anie.202000039
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号