人体胰腺类器官:进一步了解胰腺生物学和疾病治疗 BMC Developmental Biology
论文标题:Long-term expansion, genomicstability and in vivo safety of adult human pancreas organoids
作者:NikitasGeorgakopoulos, NicolePrioret al.
发表时间:2020/02/26
最近发表在BMC DevelopmentalBiology 上的一篇文章报告了一种新建立的“人体胰腺类器官”,为研究胰腺提供了新的方法。作者用取自人体胰腺的细胞创建了自组装的组织状结构,该结构以更简单的方式模拟了人体胰腺,从而帮助我们了解这个器官的发育、构成和功能。在这项研究中,作者不仅建立了这些“微型”的胰腺类器官,而且能够让这些类器官在很长的一段时间内得以扩增,同时具有持久的遗传稳定性。作者希望这种基于细胞的技术能帮助解析不断发生在细胞和组织水平上的生物过程,让我们找到越来越好的治疗干预措施,从根本上解决糖尿病、胰腺癌等许多胰腺疾病的问题。这些基于细胞的技术以及其它类似的技术有助于我们越来越深入地了解疾病,找到更加有效的疾病治疗方法。
类器官是一种在3D细胞外基质(ECM)中进行器官特异性的组织细胞培养的新技术。这种技术能形成3D细胞簇,这些细胞簇能复制许多器官来源的特征。对人体类器官模型的开发有助于我们更多地了解体内器官的形成和功能,从而帮助治愈患病的器官。
在BMC DevelopmentalBiology上发表的一项研究中,作者描述了人胰腺类器官(hPO)的产生,并展示了它们在未来研究中的用途。胰腺位于胃旁,在我们的消化系统中起关键作用。在胰腺中主要存在三种细胞类型:1)位于胰岛中的内分泌细胞,其产生各种激素,包括控制我们体内糖代谢的胰岛素;2)产生消化酶的腺泡细胞;3)形成导管的胰导管细胞(图1),用于收集消化酶并将它们运送到小肠以帮助分解食物。
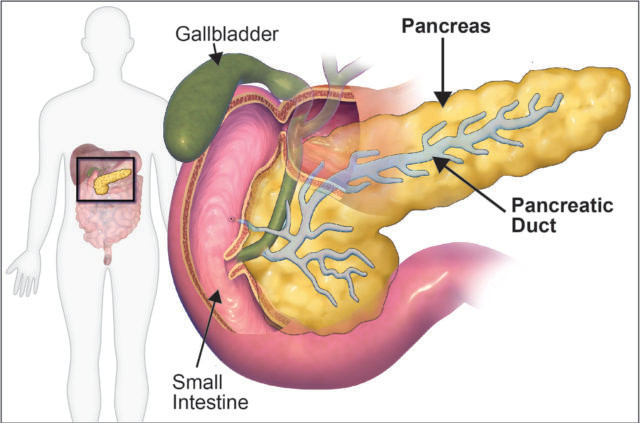
图1:胰腺是消化系统的一部分,通过胰管与肠连接。图片来源:Blausen.com staff (2014).Blausen.com staff(2014)."Medical gallery of Blausen Medical 2014". WikiJournalof Medicine 1(2).DOI:10.15347/wjm/2014.010. ISSN 2002-4436.
这些细胞的功能异常与一系列胰腺疾病有关。胰腺癌会影响所有这些细胞类型,在英国,胰腺癌的存活率是所有癌症类型中最低的。糖尿病是最常见的内分泌疾病,在英国有超过400万人患有糖尿病。其他的疾病虽然不太为人所知,但是严重程度丝毫不亚于前两个,它们包括胰腺炎(胰腺炎症)、囊性纤维化(其影响导管细胞)和胰腺功能不全(腺泡细胞功能降低)。严重的胰腺疾病常常使患者陷入绝境,不得不等待已故捐献者的胰腺或胰岛细胞进行移植。然而,胰腺移植也面临着很大的问题,一方面器官供体数量有限,且接受者需要终身服用抑制免疫的药物。
因此,我们想要建立一种3D培养系统用于长期扩增hPO,从而为研究胰腺导管细胞、胰腺疾病和开发治疗糖尿病的细胞疗法的提供基础。在开发hPO模型时,我们意识到,要使细胞疗法转化为临床,必须要符合某些标准,譬如细胞扩增有明确的化学过程,且符合生产质量管理规范(GMP),还要有有充分可靠的证据表明细胞不会有形成肿瘤的风险。
为了生成hPO,我们从人胰腺组织的小样本中分离出导管碎片,并将其置于ECM中充当3D支架。为了能让这一步顺利进行,我们开发了一种培养基,其中包含了支持胰管转变为可扩张胰腺类器官的所有信号和生长因子(图2)。我们对关键细胞信号通路的激活剂和抑制剂进行了测试,通过一系列的优化和重试后,获得了一种化学成分明确的培养基,能用于持续长期地培养胰腺细胞。此外,我们开发了一种方法来冻结胰腺组织并从中复苏出健康且可长期扩增的类器官。这样我们就能够存储组织,共享样本并在以后培养出类器官。
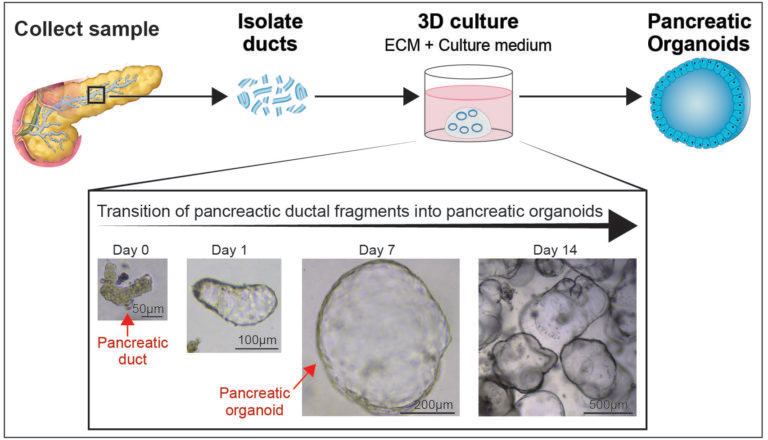
图2:人胰管可以在体外培养,并可以扩增成胰腺类器官。
重要的是,遗传分析表明,即使经过长期扩增,hPO也未显示出较大的遗传异常。这一点至关重要,因为在培养过程中累积的遗传缺陷会改变细胞行为并影响最终结果。我们还发现,将这些细胞移植到小鼠胰腺中后,hPO细胞不会形成肿瘤,表明不管是在体外还是在体内它们都具有遗传安全性。
最后,我们开发了一种化学性质的ECM用于培养hPO,因为常用的ECM(Matrigel/BME的2-RGF)是动物来源的,不适用于细胞疗法。我们与Cellendes(一家专门从事水凝胶技术的公司)合作,首次展示了hPO在完全化学性的水凝胶中的衍生和扩增。
结果显示,人胰腺类器官在化学性条件下能够长期扩增,这一系统将会为许多研究领域带来希望(图3)。该系统可以用作健康导管胰腺的生物学模型,或开发导管疾病例(如囊性纤维化)的模型。类器官也可以基于疾病状态构建,并且已经被用于模拟不同类型的胰腺癌(PDAC和IPMN)。
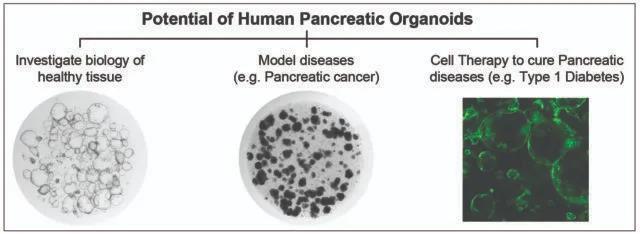
图3:人类胰腺类器官在许多研究领域都有潜在用途,例如研究健康组织、患病组织和再生医学。
关键的一点是,我们的方法不依靠改变细胞的基因组或细胞身份来实现长期的扩增,再加上移植到小鼠体内时不会形成肿瘤,hPO充分显示了能安全地用于潜在的细胞疗法。细胞疗法为无药可用的患者带来了希望。我们可以从患者或其他供体中提取细胞,在实验室中对这些细胞进行改造以产生有作用的细胞,并将它们移植到患者体内,以此来进行细胞疗法。从理论上讲,这种方式不仅可以治疗疾病,而且无需进行免疫抑制,因为这些细胞可以来源于自身,或者和患者非常匹配。
人细胞培养系统的适应性研究获得了欧盟计划(LSFM4LIFE)的资助,该计划旨在探讨hPO作为临床细胞疗法的潜力。至于hPO能否用于糖尿病细胞疗法的移植,我们还需要进行更多的研究。
摘要:
Background
Pancreaticorganoid systems have recently been described for the in vitro culture ofpancreatic ductal cells from mouse and human. Mouse pancreatic organoidsexhibit unlimited expansion potential, while previously reported human pancreasorganoid (hPO) cultures do not expand efficiently long-term in a chemicallydefined, serum-free medium. We sought to generate a 3D culture system forlong-term expansion of human pancreas ductal cells as hPOs to serve as thebasis for studies of human pancreas ductal epithelium, exocrine pancreaticdiseases and the development of a genomically stable replacement cell therapyfor diabetes mellitus.
Results
Our chemicallydefined, serum-free, human pancreas organoid culture medium supports thegeneration and expansion of hPOs with high efficiency from both fresh andcryopreserved primary tissue. hPOs can be expanded from a single cell, enablingtheir genetic manipulation and generation of clonal cultures. hPOs expanded formonths in vitro maintain their ductal morphology, biomarker expression andchromosomal integrity. Xenografts of hPOs survive long-term in vivo whentransplanted into the pancreas of immunodeficient mice. Notably, mouseorthotopic transplants show no signs of tumorigenicity. Crucially, our mediumalso supports the establishment and expansion of hPOs in a chemically defined,modifiable and scalable, biomimetic hydrogel.
Conclusions
hPOs can beexpanded long-term, from both fresh and cryopreserved human pancreas tissue ina chemically defined, serum-free medium with no detectable tumorigenicity. hPOscan be clonally expanded, genetically manipulated and are amenable to culturein a chemically defined hydrogel. hPOs therefore represent an abundant sourceof pancreas ductal cells that retain the characteristics of thetissue-of-origin, which opens up avenues for modelling diseases of the ductalepithelium and increasing understanding of human pancreas exocrine biology aswell as for potentially producing insulin-secreting cells for the treatment ofdiabetes.
本文由微信公众号“BMC期刊”提供

如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号