Trost团队Nat. Chem.:反应换个顺序,就能简化萜类合成
萜类化合物广泛存在于自然界,目前已发现超过55000种,它们在人类的日常生活中扮演着重要角色,如作为香料、香水、激素和甾体药物等等。学术界现普遍认为萜类化合物的生源合成是从简单的异戊二烯开始的(下图a),并通过“两相途径(two-phase approach)”完成——即碳正离子环化的环化酶相(cyclase phase)和C-H键氧化的氧化酶相(oxidase phase)。但目前鲜有合成化学家成功应用这种途径实现萜类化合物的仿生合成,尽管可以通过模拟环化酶相高效地制备许多复杂的萜类化合物,如虎皮楠生物碱和Sophoradiol等。但这种仿生方式仅限于“由头到尾的环化(head-to-tail cyclization)”,即通过专属性的椅式过渡态构筑十氢化萘骨架(如7)。另一方面,“由尾到头的环化(tail-to-head cyclization)”可以构筑多样性的萜类骨架,但碳正离子中间体很可能会发生E1消除或SN1反应而导致环化过程提前终止。因此,即使合成最简单的萜类化合物,也难以控制区域异构和非对映异构,并且官能团兼容性较差。
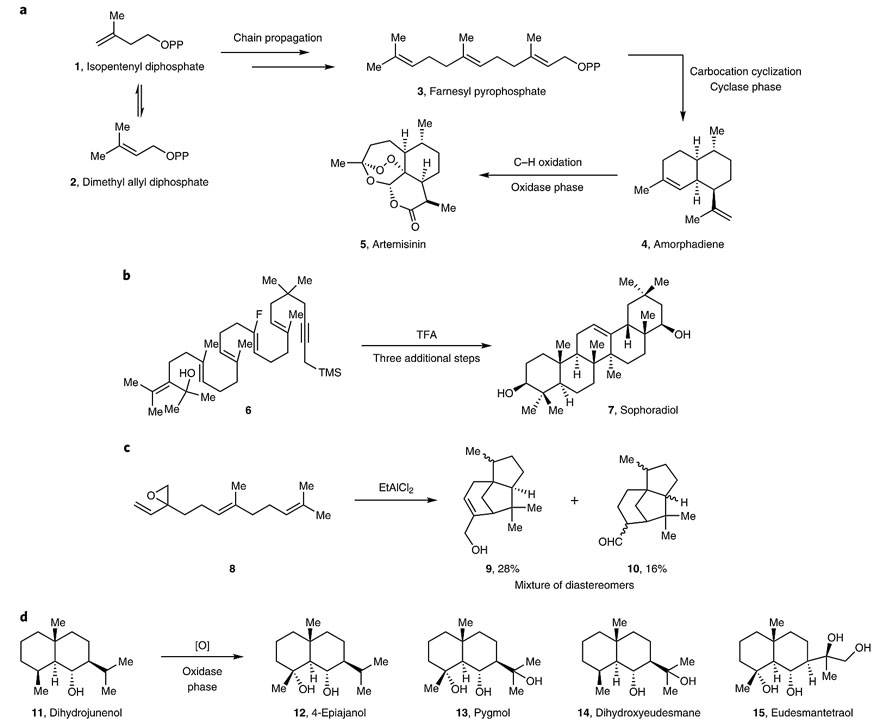
萜类生源合成和仿生合成的示例。图片来源:Nat. Chem.
2009年,P. S. Baran课题组采用两相途径并模拟了氧化酶相,以便在最低官能团化的碳环上实现C-H键氧化(Nature, 2009, 459, 824–828),但是反应的底物范围窄,也不适合后续的C-C键构筑。近日,在美国斯坦福大学长期从事环异构化反应研究的Barry M. Trost教授(点击查看介绍)及其研究团队给出了一个较为普适的解决方案——将环化和氧化的顺序调换一下。首先,将氧化酶相前置,因为在复杂体系上进行后期氧化(late-stage oxidation)是比较困难的,后者往往需要冗余的氧化还原操作;其次,预先构筑的手性含氧官能团也便于后面环化酶相的C-C键构筑,同时也有利于立体化学的控制。基于这种新合成思维,B. M. Trost教授团队首次完成了几种萜类化合物的全合成,相关结果发表在Nature Chemistry 上。
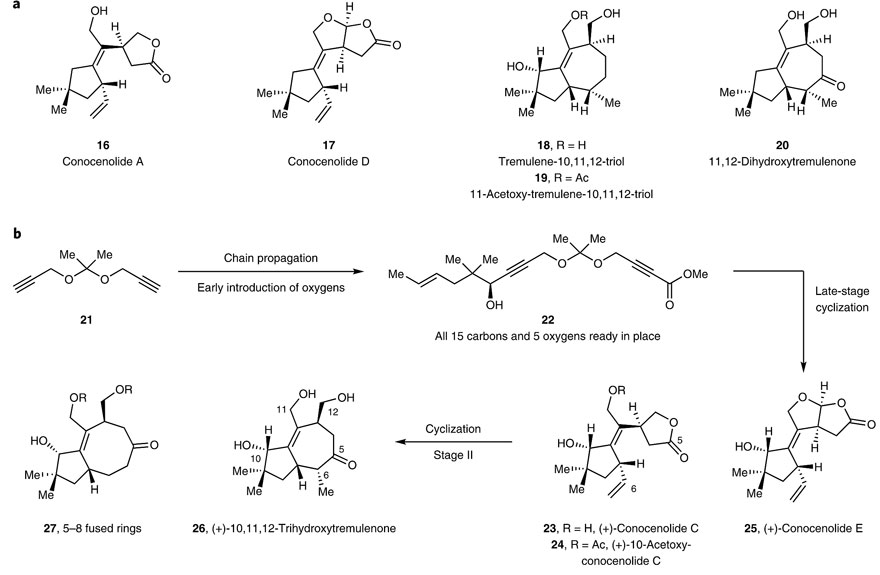
钯催化环化策略在tremulanes合成上的应用。图片来源:Nat. Chem.
不过,策略归策略,能否通过战术(合成方法学)实现是另一回事。比如,钯催化的环化反应虽然可以避免阳离子环化的一些副反应,但在π-酸性催化剂下,含氧官能团(如羟基、羰基、醚键等)相对于不饱和C-C键往往是很好的亲核试剂,因此是否能顺利发生多环化且保持这些官能团尚不可知。尽管早在1993年,B. M. Trost课题组就已经报道了钯催化的多烯环异构化反应(下图a,J. Am. Chem. Soc., 1993, 115, 12491–12509; J. Am. Chem. Soc., 1993, 115, 9421–9438),该反应可以构筑6个新的C-C键和7个环并且兼容含氧官能团。与相关的分子内Heck反应相比,该反应显示很高的原子经济性和步骤经济性。然而,由于缺乏合适的合成策略,因此它的潜力一直被低估也没有应用在天然产物的合成上。
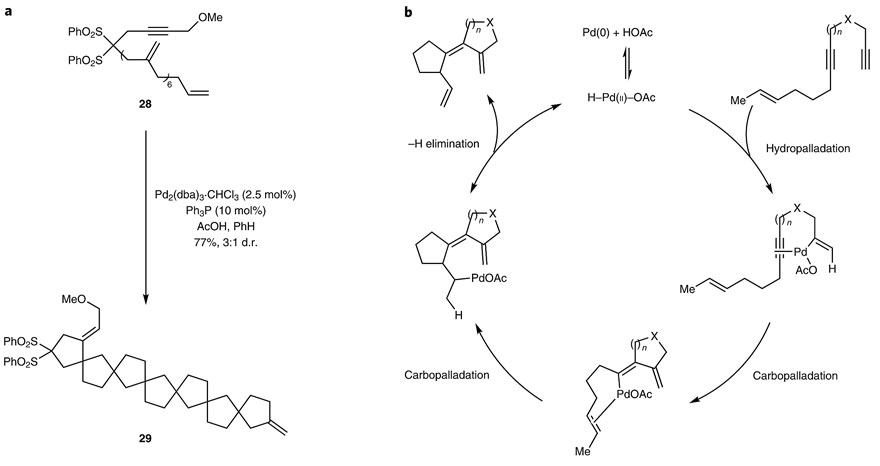
B. M. Trost课题组早期发展的钯催化多烯环异构化反应。图片来源:Nat. Chem.
为了将上述方法学应用在萜类化合物的合成上,研究人员对该反应条件进行优化。在筛选了一系列催化剂后,发现在Pd2(dba)3•CHCl3/P(o-tol)3体系下反应效果最佳,以73%的收率得到环化产物31和32(d.r. = 9:1)。此外,该反应能够耐受多种含氧基团,如缩酮、酯基以及游离的羟基。值得一提的是,游离羟基对于获得良好的d.r.值是必不可少的。尽管目前尚不清楚确切的机理,但它可能涉及到羟基的导向作用或O-叔丁基二甲基甲硅烷基(OTBS)的空间位阻。如上图b所示,研究人员提出可能的反应机理:首先是Pd(0)原位生成Pd(II)氢化物,然后对炔基进行加成(hydropalladation),随后经历两次环化(carbopalladations),最后在末端甲基上进行β-H消除,得到双环1,3,6-三烯。
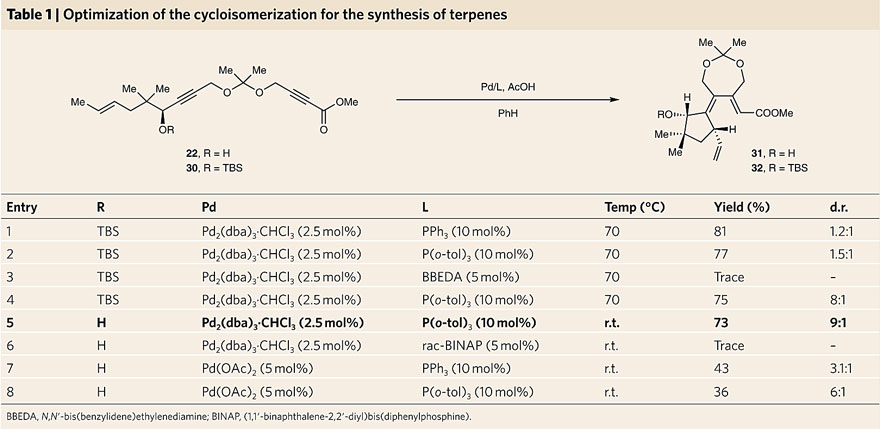
环异构化反应的优化。图片来源:Nat. Chem.
在最优条件下,研究人员以缩酮21(从廉价易得的丙炔醇以100 g规模一步制备)为起始原料,在n-BuLi和氯甲酸甲酯的条件下,得到单酯化产物33。随后在ZnMe2/ProPhenol的对映选择性催化下,末端炔烃与位阻较大的脂肪醛34进行加成得到22(> 6 g的规模)。值得一提的是,配体ProPhenol可以94%的收率回收再利用且不会明显降低反应活性或对映选择性。接着,在上述优化条件下,以8 g的规模实现钯催化的环异构化得到31,用催化量的TsOH原位转缩酮化/内酯化,以65%的收率、8:1的d.r.值得到关键中间体35。再经Buchwald发展的共轭还原体系以克级规模得到内酯36(d.r. > 20:1),最后经盐酸处理,仅需5步便能以克级规模制备(+)-conocenolide C。而(+)-conocenolide C在仲醇的存在下,选择性地在伯烯丙基醇上发生乙酰化得到(+)-10-acetoxy-conocenolide C。此外,中间体35也可以通过羟基化/原位TBS保护后以51%的总收率、4:1的d.r.值得到硅醚38,再经上述共轭还原和酸处理便可制备(+)-conocenolide E,收率81%。
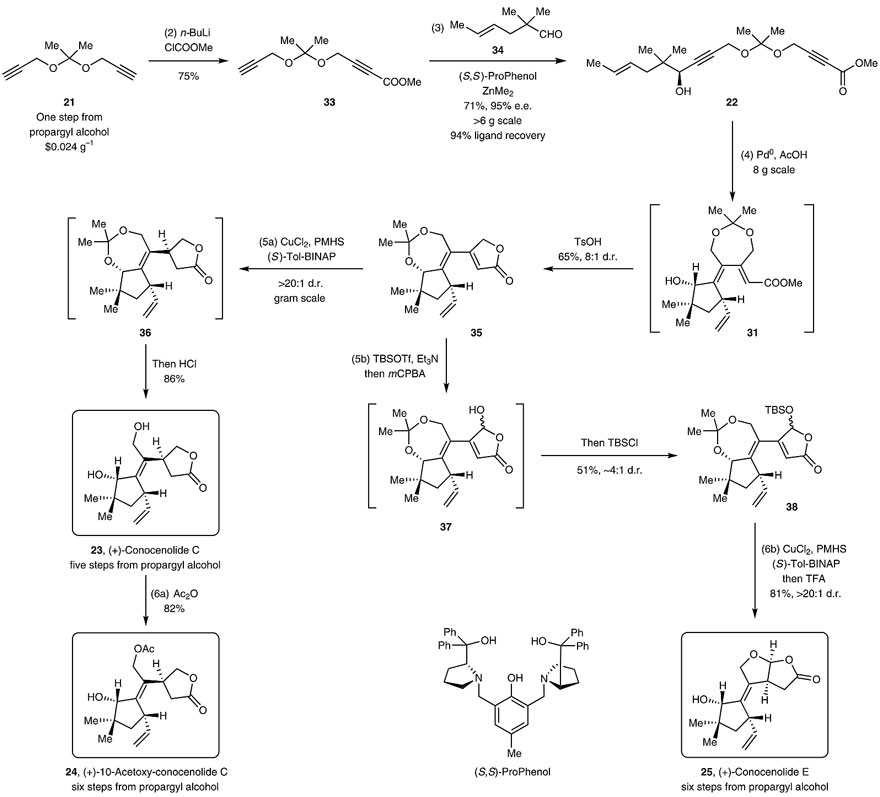
Conocenolide C等化合物的合成。图片来源:Nat. Chem.
为了进一步显示该策略的更大应用潜力,研究人员对更为复杂的tremulane家族化合物进行了合成,因为它们含有一个在合成上很有挑战性的5-7稠环。起初,研究人员想直接通过36的羰基自由基对未活化的末端烯烃进行7-exo-环化,但是并未成功,这可能是由于五元环内酯难以进行单电子转移还原。通过文献调研,发现Reisman等人曾用酰基硒作为酰基自由基前体(Org. Lett., 2018, 20, 3793–3796),在AIBN作为引发剂、TMS3SiH作为氢源的条件下构筑环系化合物。受此启发,研究人员先将内酯36水解并转化为酰基硒化合物39,在Et3B/空气作为引发剂、TMS3SiH作为氢源的条件下构筑了5-7稠环40,尽管观察到几乎等量的8-endo-环化产物。用盐酸处理后,能够以40%的收率得到(+)-10,11,12-trihydroxytremulenone 26。鉴于5-8稠环广泛存在于萜类化合物和相关药物中,于是,研究人员尝试选择性地制备八元环。当羟基被TBS保护后,8-endo环化便成了优势反应,这可能是由于在垂悬的烯烃末端碳上进行自由基加成时具有有利的构型。但也有可能是酰基自由基43通过7-exo-trig环化得到中间体44,随后发生3-exo-trig环化得到45,然后开环并攫取氢原子形成八元环产物27。
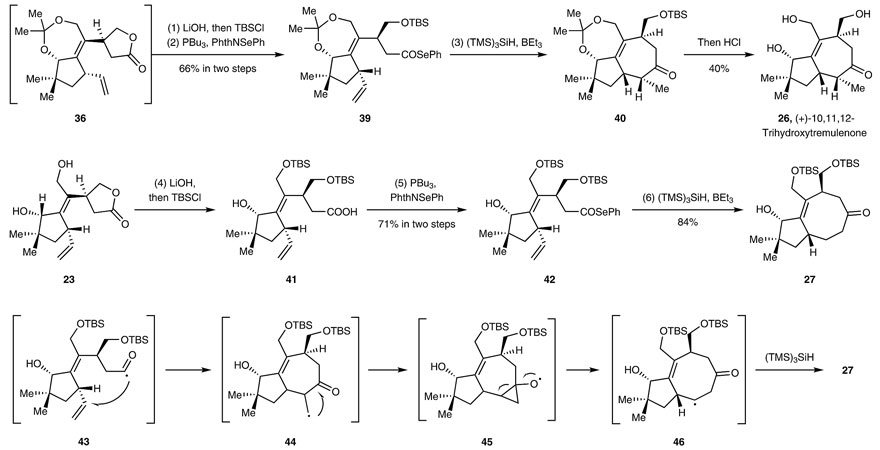
自由基反应构筑5–7和5–8稠环。图片来源:Nat. Chem.
总结
B. M. Trost课题组通过改变萜类化合物两相生源合成途径的顺序,简化了萜类化合物的合成步骤,从炔丙醇出发,仅需5-8步便可高效地完成四个倍半萜的全合成(23-26)。该反应的关键在于钯催化的多烯炔环异构化反应,不仅可以耐受多种含氧官能团,而且还可以通过它们来促进反应的进行。该策略为仿生两相合成提供了可行的替代方法,期望未来可以应用于更多萜类化合物的合成中。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Total synthesis of terpenes via palladium-catalysed cyclization strategy
Barry M. Trost , Chang Min
Nat. Chem., 2020, DOI: 10.1038/s41557-020-0439-y
导师介绍
Barry M. Trost
https://www.x-mol.com/university/faculty/433
(本文由峰千朵供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号