Nature:全自动“径向合成”,开启合成化学的“互联网+”?
常见的多步有机合成策略大体可分两类——循环合成和线性合成。对于肽、寡聚核苷酸、低聚糖等生物大分子来说,一般通过活化、偶联、脱保护的迭代循环来合成。对于小分子来说,有小部分也可以通过迭代循环来合成,比如使用Suzuki–Miyaura偶联反应来连接预功能化的合成砌块(Science, 2015, 347, 1221-1226,点击阅读详细),但大部分通常要使用一步步合成的线性策略。无论是循环合成还是线性合成,目前都已经有自动化的方案,多肽或DNA链的循环自动合成早已经市场化,而新兴的基于连续流动化学的小分子线性合成也表现出了很好的重现性和反应可控性(Science, 2016, 352, 61-67,点击阅读详细)。不过,连续的多步线性合成工艺开发起来相当复杂,而且在操作上也存在技术挑战,因为每一步都要使用各种设备,包括泵、反应器、冷却器、加热器和混合器。由于所有步骤都同时进行,因此在多步连续过程中也无法避免设备冗余。也就是说,尽管可以实现高通量生产,但工艺开发也会变得十分复杂。
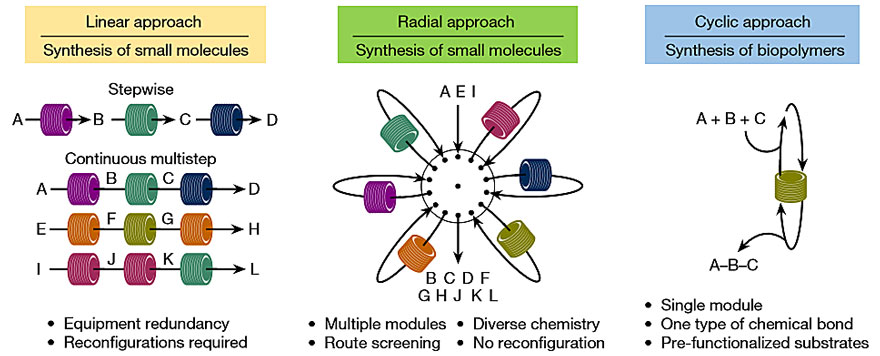
图1. 有机合成的方式。图片来源:Nature
有没有办法把循环合成和线性合成的优势集合在一起呢?
近日,德国马克斯-普朗克胶体与界面研究所的Kerry Gilmore博士等研究者给出了肯定的答复。他们在Nature 上报道了一种新型的自动化径向合成(radial synthesis)设备,用于小分子自动化合成,集循环合成和线性合成的优势于一身。该设备的核心是中转站(central switching station,CSS)单元,在其周围呈放射状排列与之相连的一系列连续流动模块。这种全自动设备能够进行线性合成和汇聚合成,且不需要在不同工艺之间进行费时费力的手动调整,便能有效地合成各种类型的小分子,比如抗惊厥药卢非酰胺及其衍生物。
如图2a所示,这种径向合成设备由四个部分组成:溶剂和试剂输送系统(RDS)、中转站(CSS)、备用模块(SM)和收集容器(CV)。其中,中转站包括一系列相互独立的反应器和在线分析仪器。在径向合成过程中,并不是同时进行多个单步转换或多步反应的多个步骤,而是相互分开、顺序地连续发生。这样一来,反应器可以在不同条件下重复使用,并且停留时间可按需控制,而与任何先前步骤无关。这不仅大大减少了所需设备的数量,也避免了不同合成工艺之间切换时的系统重构。
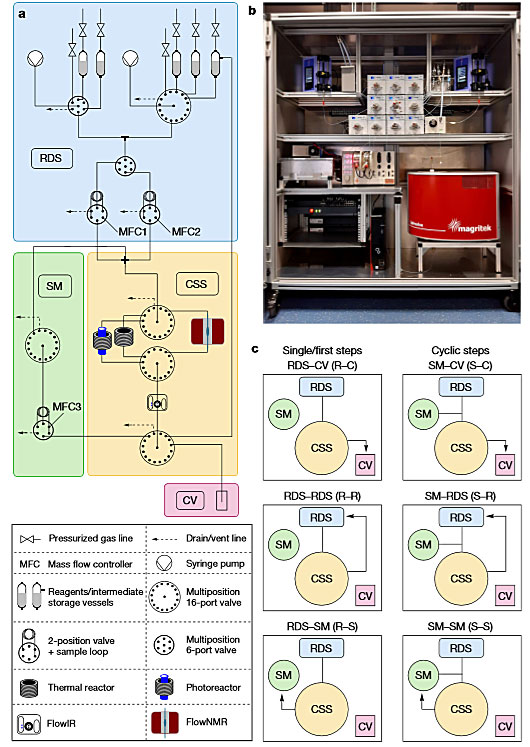
图2. 径向合成设备。图片来源:Nature
这种径向合成设备的工作流程大致如下:首先,RDS分别泵入所需的反应物和溶剂,然后通过四通接头将其混合并传递到CSS,CSS将混合物转移到合适模块——反应器或在线分析装置(flowNMR),反应或分析按预设时间完成之后,溶液离开该模块并回到CSS,经过在线IR分析装置(flowIR)之后,按照需求的不同在预设程序的控制下分别进入CV(比如单步反应的产物,无需下一步反应)、RDS中的储液管(比如汇聚合成中得到的中间体,备用)和SM中的样品环(比如线性合成中的得到的中间体,准备作为下一步反应的反应物使用)(图2c)。由于反应相互独立,因此这种径向合成设备在切换不同的合成工艺时不需要进行重构,同一反应器可在一个连续的过程中在不同的温度下使用,在不更换设备的情况下能以任意顺序组合更长或更短的停留时间。此外,由于RDS中可预存多种溶剂,反应物溶液在进入样品环之前还可以按需稀释,这种径向合成设备还可以大大加速反应条件的筛选和优化。
接下来就是用实验来验证设想了。作者分别使用线性合成和汇聚合成对抗惊厥药卢非酰胺进行了合成(图3)。对于汇聚合成,在优化最终的铜催化环加成反应前,需要对叠氮化物2和酰胺4的合成进行两次独立的优化。使用R–C路径优化了C1和C2步骤,通过FlowIR在线监测转化率,并通过离线分析收集的样品确定产率。为了优化C3步骤,在环加成之前,分别合成叠氮化物2和酰胺4并存储在RDS和SM中。完成优化后,按照R–R、R–S、S–C路径执行了三步汇聚径向合成。在不加压的容器中收集溶液,卢非酰胺在反应开始后的五分钟内结晶。过滤和洗涤以70%的收率(88% NMR收率)得到纯的卢非酰胺。
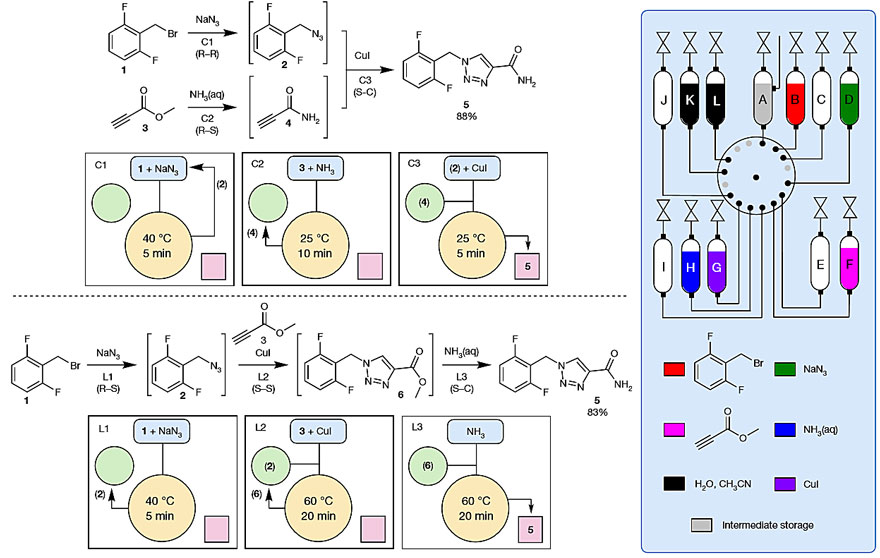
图3. 直接比较合成卢非酰胺的途径。图片来源:Nature
对于线性合成,在优化过程中,发现中间体6在所使用的浓度下是不溶的。使用RDS在线稀释试剂1和3(从1.5 M到1 M)就可以三步线性合成卢非酰胺(L1、L2、L3),无需手动调整RDS中存储的试剂。除了浓度不同,L1与C1的条件相同。在优化这三个步骤之后,遵循R–S、S–S、S–C路径进行线性合成。最后一步(S-C)是将溶液收集在未加压的容器中,并通过手动添加1 mL的软化水使卢非酰胺结晶。过滤和洗涤以45%的收率(83% NMR收率)得到纯的卢非酰胺。
对比这两种合成方法,作者发现杂环加合物的溶解度是一个关键挑战。在汇聚合成的最后一步中可以使用更浓缩的溶液(1.5 M vs 1.0 M),并且纯化过程较为简单,因为产物会在离开仪器时沉淀出来;而线性合成则需要加水,并且结晶产率(70% vs 45%)和1H NMR产率(88% vs 83%)均比汇聚合成低。也就是说,这种径向合成设备可以帮助化学家快速实现不同合成路线的比较。
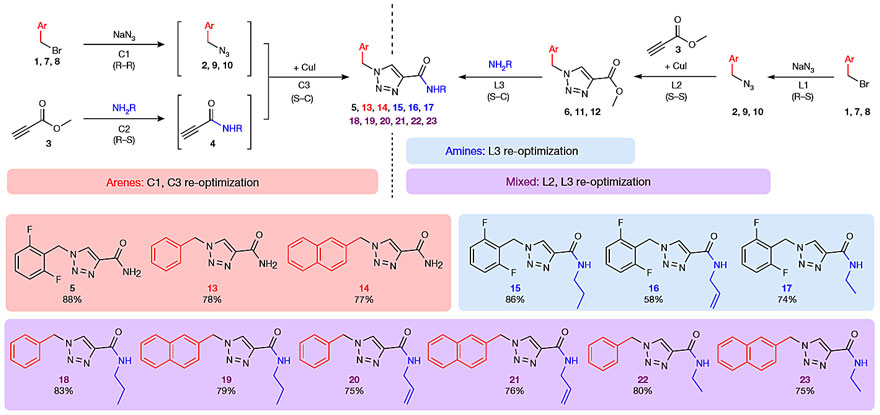
图4. 卢非酰胺衍生物库的合成。图片来源:Nature
为了进一步探究这种径向合成设备的适用性,作者将其用于卢非酰胺衍生物库的合成,以较高的收率制备了多种衍生物(图4)。此外,这种径向合成设备还可以进一步扩展,作者仅仅添加了一个光化学模块(420 nm LED光反应器),使用相同试剂,无需重构反应体系,就可进行更广泛、更多样化的化学过程。他们以良好的分离收率得到了卢非酰胺衍生物(30、31)。
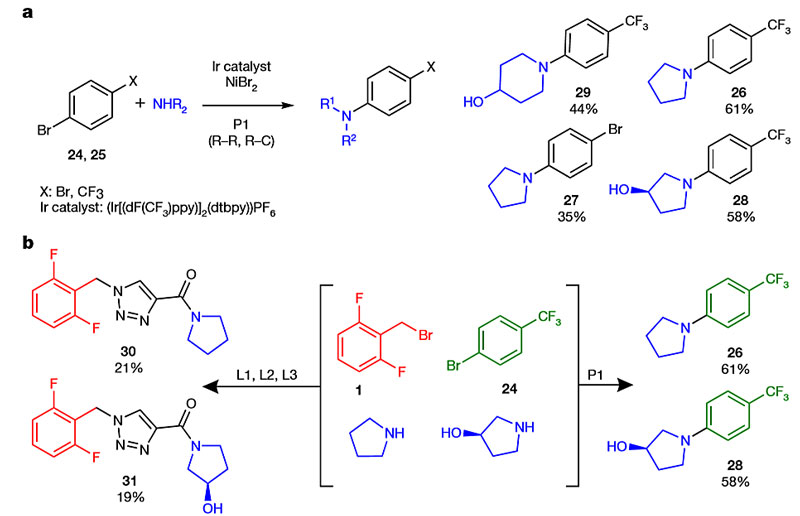
图5. 系统功能的模块化扩展。图片来源:Nature
总结
Kerry Gilmore博士等人发展的径向自动合成仪既可以进行线性合成和汇聚合成,也可以在线稀释进行浓度和溶剂筛选,并按需实现单步或多步合成,无需手动重构仪器。另外,反应器可以在不同的温度和流速下重复使用,而中间体可以存储起来用于汇聚合成和多步优化。
Kerry Gilmore表示:“该仪器可以说是首个真正通用的自动化合成设备……在不久的将来,我们设想建立一个‘化学服务器’,提供数百个这样的自动化平台,科学家可以从世界任何地方登录进来做实验。”[1]坐在电脑前点点手指就可以遥控互联网另一端的设备做实验拿数据,或许很快就不是梦了。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Automated radial synthesis of organic molecules
Sourav Chatterjee, Mara Guidi, Peter H. Seeberger, Kerry Gilmore
Nature, 2020, 579, 379-384, DOI: 10.1038/s41586-020-2083-5
参考文献:
1. Automated radial synthesis could usher in era of chemistry ‘server farms’
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号