接触角定量标定蛋白质环境中氨基酸的亲疏水性
疏水作用是蛋白质折叠成3D结构的重要驱动力。因此定量标定蛋白质环境中氨基酸的亲疏水性对于理解蛋白质在生物环境中的功能以及预测蛋白质结构具有非常重要的作用。在工程领域,宏观平面的亲疏水性通常由水滴在其表面的接触角的大小来标定。然而,由于氨基酸具有非常高的曲率,以及它的尺寸非常小(纳米量级),宏观接触角并不能被用于标定氨基酸的亲疏水性。因此科学家们提出了一系列间接的方法去标定氨基酸的亲疏水性。比如用氨基酸在两种不混溶液相中的分布情况来标定,再比如用统计力学方法计算得到的已知结构蛋白质中可及面积以及包埋面积来标定。然而这些方法得到的亲疏水性参数缺乏关联性,并且不具有系统间的可移植性。在某些情况下,用于标定某个特定氨基酸亲疏水性的数值结果甚至是互相矛盾的。而且这些方法会常常忽略蛋白质环境因素。
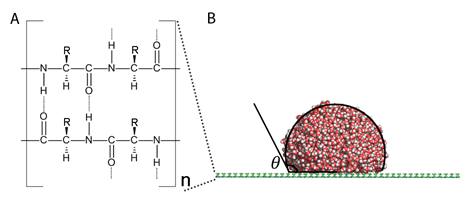
图1、(A)根据蛋白质一级结构及二级结构中的β折叠构建的平面肽网络。(B)分子动力学模拟体系的侧视图以及纳米水滴在表面的接触角的图示。
近日,美国内布拉斯加大学林肯分校曾晓成教授(Chancellor′s University大学讲席教授)、美国化学学会前主席Joesph S. Francisco院士研究团队与中科院物理研究所的李晖副研究员、孟胜研究员合作,根据蛋白质的一级结构和二级结构中的β折叠,用同一种氨基酸构建了平面的肽网络。通过分子动力学模拟,曾晓成和Francisco团队计算了水在全部20种单一氨基酸构成的平面肽网络的接触角。他们的计算结果表明所有的非极性氨基酸都是疏水的(θ>90°),所有的极性氨基酸和带电氨基酸都是亲水的(θ< 90°)。特别的所有带电氨基酸都是完全亲水的(θ= 0°)。

图2、在分子动力学模拟结束时,纳米水滴在单一的非极性氨基酸(A)和极性氨基酸(B)组成的平面肽网络上的快照。
为了标定完全亲水氨基酸的亲水性,曾晓成和Francisco团队进一步的计算了甲烷尺寸的纯排斥WCA溶质在平面肽网络固液界面的过化学势。他们的计算结果表明甲烷尺寸的纯排斥WCA溶质在平面肽网络固液界面过化学势的极小值(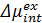 )与水滴的接触角的余弦值成线性关系(COSθ),这与之前的研究结果相符合。根据这个线性关系,由完全亲水氨基酸的
)与水滴的接触角的余弦值成线性关系(COSθ),这与之前的研究结果相符合。根据这个线性关系,由完全亲水氨基酸的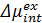 可以计算得到纳米水滴在其表面COSθ的外推值。这是第一次用水滴接触角定量标定了蛋白质环境中全部20种氨基酸的亲疏水性,对蛋白质3D结构的预测起着重要作用。
可以计算得到纳米水滴在其表面COSθ的外推值。这是第一次用水滴接触角定量标定了蛋白质环境中全部20种氨基酸的亲疏水性,对蛋白质3D结构的预测起着重要作用。

图3、(A)纯排斥甲烷大小的WCA溶质在肽网络-水界面过化学势的极小值(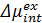 )随着水滴在其表面的接触角的余弦值(COSθ)的变化关系 (B)计算得到的水滴在不同氨基酸组成的平面肽网络表面的接触角的余弦值(COSθ)以及纯排斥甲烷大小的WCA溶质在肽网络-水界面过化学势的极小值(
)随着水滴在其表面的接触角的余弦值(COSθ)的变化关系 (B)计算得到的水滴在不同氨基酸组成的平面肽网络表面的接触角的余弦值(COSθ)以及纯排斥甲烷大小的WCA溶质在肽网络-水界面过化学势的极小值(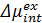 )
)
这一成果近期发表在《Proceeding of the National Academy of Sciences of the United States of America》上,氨基酸的全新亲疏水性标度已被维基百科收录。文章的第一作者包括内布拉斯加大学林肯分校的朱重钦博士、加州州立大学北岭分校的高玉瑞博士以及中科院物理研究所的李晖副研究员。
https://en.wikipedia.org/wiki/Hydrophobicity_scales
该论文作者为:Chongqin Zhu, Yurui Gao, Hui Li, Sheng Meng, Lei Li, Joseph S. Francisco, Xiao Cheng Zeng
原文(扫描或长按二维码,识别后直达原文页面):

http://www.pnas.org/content/113/46/12946
Characterizing hydrophobicity of amino acid side chains in a protein environment via measuring contact angle of a water nanodroplet on planar peptide network
PNAS, 2016, 113, 12946-12951, DOI: 10.1073/pnas.1616138113
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号