对映选择性aza-Sakurai环化:硫脲的两个角色,氢键供体和Lewis碱
吲哚里西啶和喹诺里西啶类生物碱骨架存在于很多生物活性的分子中,分子内的亚胺和烯丙基硅试剂的aza-Sakurai环化反应是合成该类杂环化合物的主要方法。最近,“Asymmetric anion-binding”催化被广泛用于实现N-酰基亚胺正离子和一系列亲核试剂如吲哚、多烯等的加成反应。来自美国哈佛大学的Eric N. Jacobsen教授(点击查看介绍)由此设想并实现了由手性硫脲辅助氯代内酰胺形成亚胺正离子,进行不对称aza-Sakurai环化反应,从而有效构建手性双环内酰胺化合物(Scheme 1)并且揭示了硫脲活化的一个新模式。在活化过程中,硫脲不仅发挥氢键供体作用,还发挥了Lewis碱的角色。(Enantioselective Aza-Sakurai Cyclizations: DualRole of Thiourea as H-bond Donor and Lewis Base, J. Am. Chem. Soc., 2016, 138, 14848-14851, DOI: 10.1021/jacs.6b09736)
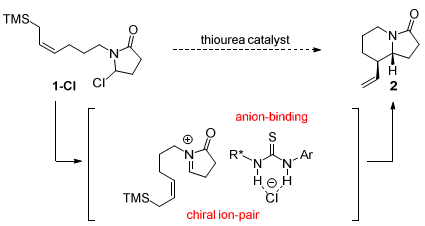
Scheme 1. aza-Sakurai环化。图片来源:J. Am. Chem. Soc.
作者首先使用1作为模板底物对一系列的手性硫脲催化剂进行了筛选。综合考虑产物的产率和对映选择性,催化剂3e脱颖而出。作者还对反应温度,溶剂等一系列参数进行了考察。最佳反应条件是:3e作为催化剂,TBME作为溶剂,4 ℃作为反应温度。在最佳反应条件下,能以85%的产率和91%的对映选择性得到目标产物2(Scheme 2)。
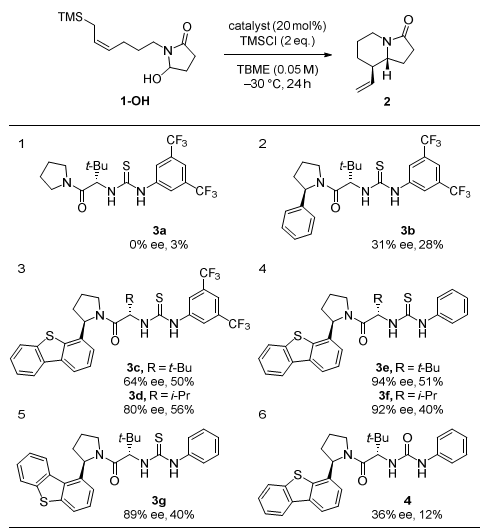
Scheme 2. 条件筛选。图片来源:J. Am. Chem. Soc.
在最佳条件下,作者对底物的普适性进行了考察。主要考察了内酰胺部分。当使用氨基甲酸酯衍生物5作为底物时,表现出与底物1类似的催化结果。当使用内酰脲7作为底物时,能以82%的产率和94%的对映选择性得到目标产物8。戊二酰亚胺衍生的底物9和二氢尿嘧啶衍生的氮上带有不同取代基的底物11和13以优秀的产率和对映选择性得到目标产物10、12和14。而当使用三取代的烯丙基硅衍生物15作为底物时,催化剂3g表现出更高的选择性,能以85%产率和88%对映选择性得到目标产物(Table 1)。
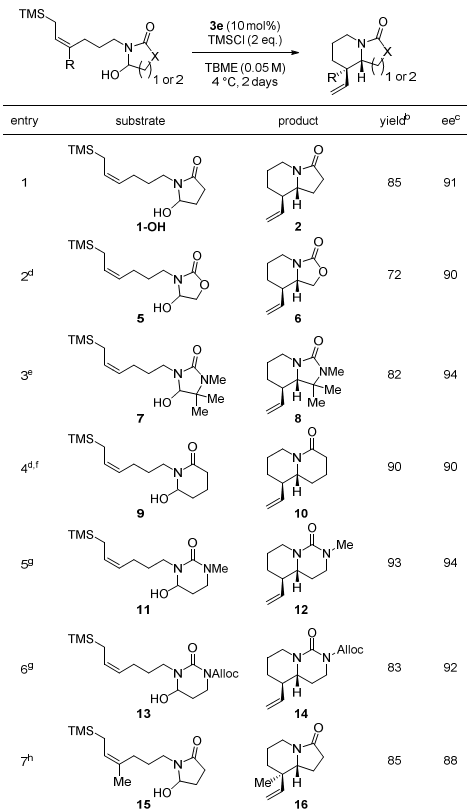
Table 1. 底物拓展。图片来源:J. Am. Chem. Soc.
使用产物ent-2和10作为起始原料,只需要两步反应就可简单高效的合成两个重要的天然产物tashiromine和(+)-epi-lupinine。从该类转化可看出本文方法的优越性和重要性。通过这两个天然产物的合成,也确定了产物ent-2和10的绝对构型(Scheme 3)。
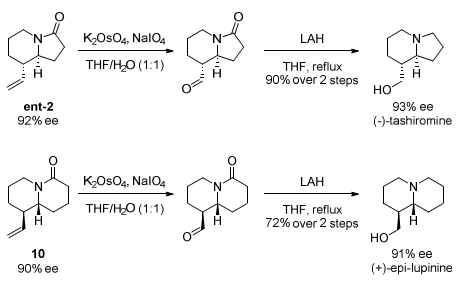
Scheme 3. 全合成研究。图片来源:J. Am. Chem. Soc.
随后,作者比较了催化剂结构和底物结构改变对反应结果的影响。对同一个底物1而言,催化剂4表现出很低的选择性。与催化剂3e相比,催化剂4只是把硫脲变为脲。从该结果可以看出,催化剂3e的硫脲部分不仅起到一个氢键供体的作用,还发挥了Lewis碱的角色。此外,底物中不同的烷基硅取代基对反应的结果影响也很大。当使用三异丙基硅时,只能以33%的对映选择性得到产物(Table 2)。
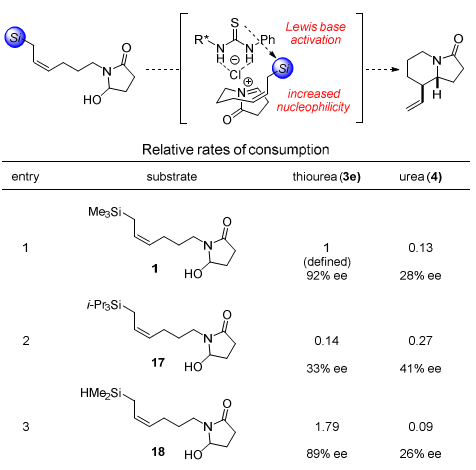
Table 2. 控制实验。图片来源:J. Am. Chem. Soc.
作者通过研究改变催化剂和底物两者的结构对实验结果的影响,提出了如下的反应机理:首先,半缩醛在TMSCl的辅助下生成氯代内酰胺,随后在手性硫脲催化剂的参与下攫取氯离子生成中间体,紧接着该中间体硫脲的硫原子部分发挥Lewis碱作用活化烯丙基硅,最后进行关环(Scheme 4)。
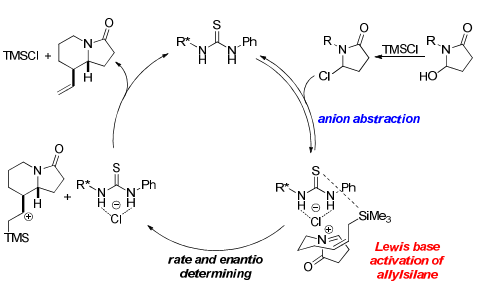
Scheme 4. 反应机理。图片来源:J. Am. Chem. Soc.
总结:
本文介绍了有机小分子催化的aza-Sakurai环化反应。该反应不仅以高产率、高对映选择性得到吲哚里西啶和喹诺里西啶类衍生物,更为重要的是催化剂和产物对映选择性之间的关系揭示了硫脲催化剂不仅是氢键供体,还发挥了Lewis碱的作用。
http://pubs.acs.org/doi/abs/10.1021/jacs.6b09736
导师介绍
Eric N. Jacobsen教授:http://www.x-mol.com/university/faculty/26725
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
硫脲协作的铑双膦配体催化氢化:高效合成手性琥珀酰亚胺 2016-11-22
-
三级烯酰胺催化不对称串联反应合成吲哚里西丁类生物碱的衍生物 2016-05-06
-
超高活性有机催化剂,促进烯丙基三甲基硅对醛的高对映选择性加成 2016-10-23


































 京公网安备 11010802027423号
京公网安备 11010802027423号