“即插即用”抗癌药物载体——瓜环与金属有机多面体的结合
在过去的二十年里,发展新的药物运输系统是化学、生物、医药等领域的一个主要研究热点,通过控制药代动力学和体内生物学分布来提高药物性能和减少副作用。科学家们研究了各种载药系统,比如蛋白质偶联药物、高分子偶联药物、聚合物囊泡、纳米胶束、树状大分子、高分子纳米粒子以及金属纳米粒子等等。但还是有一些药物仍然缺乏特别理想的载药系统解决方案,比如抗癌药物多柔米星(doxorubicin),依然存在着心脏毒性和清除过快等缺点。常见减少药物毒性的方法就是控制药物只在靶标附近(例如癌变细胞中)释放,但是多柔米星因为细胞内化非常缓慢,其抗癌活性大大降低。
近日,美国马里兰大学Lyle Issacs教授(点击查看介绍)研究团队在JACS报道了一种利用结合了金属有机多面体(metal-organic polyhedron,MOP)和瓜环的载药系统,可提高多柔米星对HeLa细胞(一种癌症模式细胞)的细胞毒性近10倍。(Metal-Organic Polyhedron Capped with Cucurbit[8]uril Delivers Doxorubicin to Cancer Cells. J. Am. Chem. Soc., 2016, DOI: 10.1021/jacs.6b09504)
通常情况下,纳米粒子的大小影响其在血液中存留的时间。相比于小粒子,大粒子滞留时间更长,对治疗诊断更有帮助,并且可以提高肿瘤细胞对药物的吸收。这种现象归因于EPR(enhanced permeability and retention)效应,也叫高渗透长滞留效应,是指一些特定大小的大分子物质(如脂质体、纳米颗粒以及一些大分子药物)更容易渗透进入肿瘤组织并长期滞留(和正常组织相比)的现象。Issacs等人采用的超分子结构结合了日本东京大学Fujita组之前报道过的金属有机笼和两种不同大小的瓜环,其粒子大小在5-6 nm左右,4倍于之前所报道过的一些载药粒子。
作者首先合成了带有甲基紫精的配体1,这种配体与Pd2+离子配位,形成金属有机笼MOP3。MOP3带有72价的正离子,并且可以溶于水,伸展出的甲基紫精结构可以与瓜环[7]或瓜环[8]结合,分别形成MOP4、MOP5。

图1. MOP4、MOP5的形成过程。图片来源:JACS
其中瓜环[8]空腔大于瓜环[7],在其空腔中还可以容纳另一分子2,6-二羟基萘,作者巧妙的将多柔米星链接到了2,6-二羟基萘上形成药物前体2,并将药物前体2以“即插即用”的方式负载到MOP5上形成MOP7(下图)。
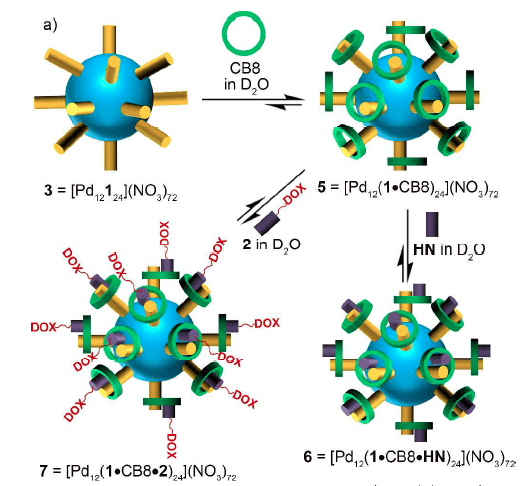
图2. MOP3与瓜环8结合形成MOP5,MOP5与2,6-二羟基萘结合形成MOP6,MOP5与载有多柔米星的药物前体2结合形成MOP7。图片来源:JACS
为了最小化多柔米星的副作用并最大化药物活性,多柔米星在被癌细胞高效内化后,还能够被及时释放至关重要。于是作者检测了pH值对药物的释放影响,在pH = 7.4时,没有释放;pH = 4时,超过90%的多柔米星可以被释放。这意味着,药物前体在偏中性的血液循环中不会被释放,在被癌细胞内化后在细胞偏酸的内环境中才会被释放。接着作者在细胞实验中进行了验证,测试了药物前体2和MOP7对HeLa细胞的细胞毒性,IC50值分别为500 ± 110 nM和48 ± 8 nM,活性有接近10倍的提高,证明这种策略的确有应用潜力。
Issacs等人巧妙的结合了金属有机多面体和瓜环作为载药系统,可以实现多柔米星的“即插即用”式药物运输和释放,这或许能为药物运输系统的开发提供新的思路。
1. http://pubs.acs.org/doi/abs/10.1021/jacs.6b09504
2. https://en.wikipedia.org/wiki/Enhanced_permeability_and_retention_effect
导师介绍
Lyle Issacs教授:http://www.x-mol.com/university/faculty/1003
(本文由PhillyEM供稿)
