Nature Chem.:用亲芳香体去芳香化
芳烃是最基本的化学原料,每年生产规模达百万吨,用于聚合物、染料、农药、医药等诸多领域。去芳香化反应可以把简单易得的芳烃转化为更复杂的、具有广泛应用潜质的复杂分子,用途十分广泛。尽管这一领域取得了一些成果和进展,但实现简单芳烃的选择性去芳香化并衍生化,还是很少有方法见诸报道。
近期,伊利诺伊大学厄巴纳-香槟分校(UIUC)的助理教授David Sarlah在Nature Chemistry上报道了他们在去芳香化反应上的新突破。先介绍下David Sarlah,他2011年在Scripps研究所获得博士学位,导师K. C. Nicolaou,2011年-2014年在ETH Erick M. Carreira课题组做博士后,2014年10月加入UIUC担任助理教授。

David Sarlah博士。图片来源:University of Illinois at Urbana-Champaign
作者采用了可见光活化的含有杂原子的小分子即亲芳香体(arenophiles)和多种芳香化合物的发生环加成反应,该策略使用N-N亲芳香体实现了简单芳烃的去芳香化双羟化反应和双胺化双羟化反应,提供了一种直接且选择性地得到高度官能团化的环己烯和环己二烯的方法,这是对现有的化学和生物去芳香化的重要补强。最后,作者还把该方法用于了一些具有活性的分子和天然产物的全合成,证明了该去芳香化策略的适用性。(Dearomative dihydroxylation with arenophiles. Nature Chem., 2016, DOI: 10.1038/nchem.2594)
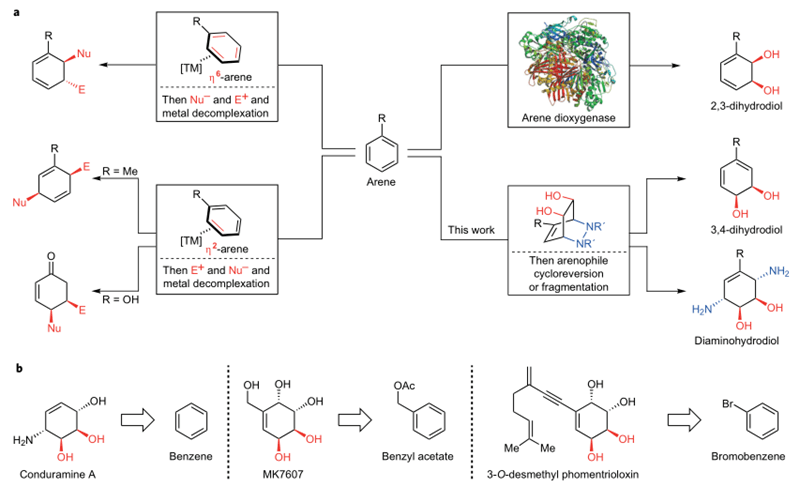
图1. 芳烃去芳香化策略。图片来源:Nature Chem.
如图1a所示,传统的芳烃去芳香化的策略就是利用过渡金属催化,与芳烃形成复合物,进而被亲核试剂和亲电试剂捕获,或者是在芳烃双羟化酶3EN1的作用下形成2,3-二羟基的衍生物,这是微生物将单取代单核芳烃双羟化的关键酶。本文的工作则是在可见光的作用下,芳烃和亲芳香体发生环加成反应进而开环或者碎裂化生成3,4-二羟基衍生物或者二胺基二羟基衍生物。
作者也对反应机理进行了研究,亲芳香体在可见光的激发下形成激发态,进而和芳烃形成激发态的复合物,接着形成相应的环加成产物。作者也对A1-A6六种不同亲芳香体和苯的反应进行了计算化学的研究,可以看出,A1-A4作为亲芳香体,提供LUMO,苯提供HOMO,能量间距都是较小的,事实上,A1、A2、A4也都表现出了期望的活性,但作者最终选择了4-methyl-1,2,4-triazoline-3,5-dione(A2),这是由于它易于制备,并且比较稳定。从图c中也可以看出,反应过程中有明显的颜色变化。

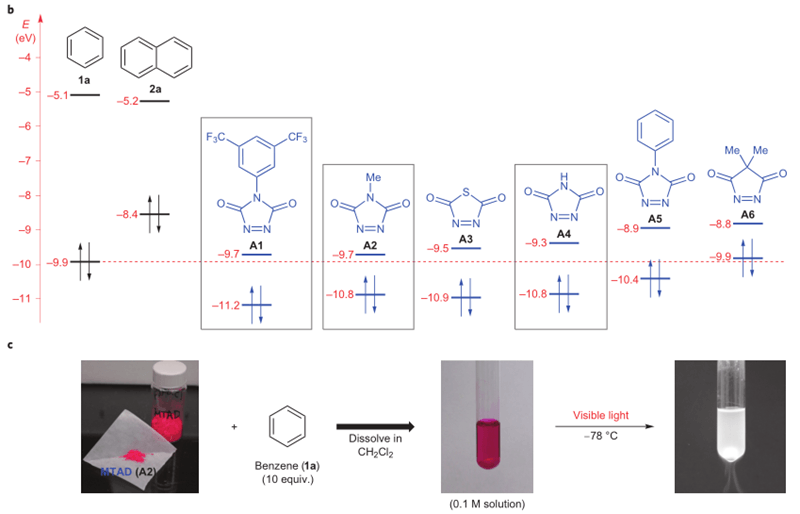
图2. 芳烃和亲芳香体去芳香化反应机理。图片来源:Nature Chem.
接着,作者对反应底物进行了扩展,对于带有不同烷基、硅基、乙酰氧基、缩醛、卤素等的单取代苯1,在和亲芳香体A2发生环加成反应后,在A条件下,OsO4 (5 mol%), NMO (1.2 equiv.), p-TsNH2 (1.2 equiv.), H2O (20 equiv.), acetone (0.1 M based on A2), -78 °C to 0 °C,发生双羟化得到产物3;而在B条件下,arene (1, 10 equiv.), A2 (1.0 equiv.), VLEDs, CH2Cl2 (0.1 M based on A2), -78 °C, 4 h; then OsO4 (5 mol%), NMO (1.2 equiv.), n-BuB(OH) 2 (1.2 equiv.), CH2Cl2 , -78 °C to 0 °C,发生双羟化后形成了硼酸酯得到产物4。
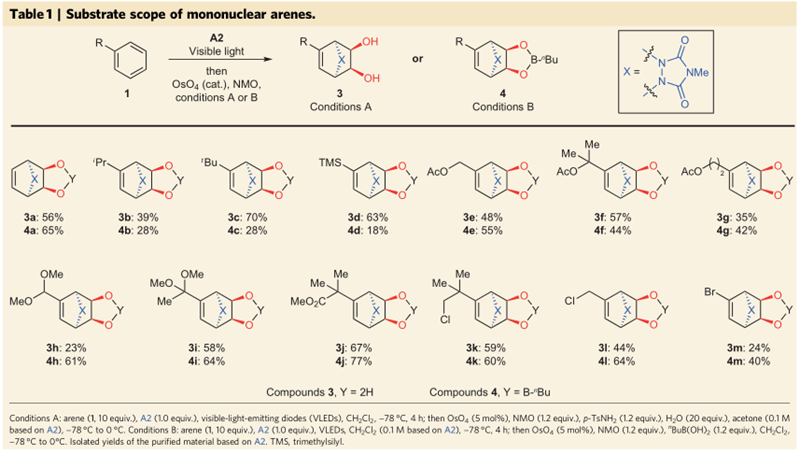
图3. 反应底物的扩展。图片来源:Nature Chem.
而去芳香化后的环加成产物5则在肼或者氢氧化钾以及氯化铜的条件下发生逆环加成反应得到环己二烯类产物6,产率优良;而在肼解后加入苯甲酰氯,在二碘化钐存在的条件下得到二胺基取代的环己烯产物7,产率中等到良好。
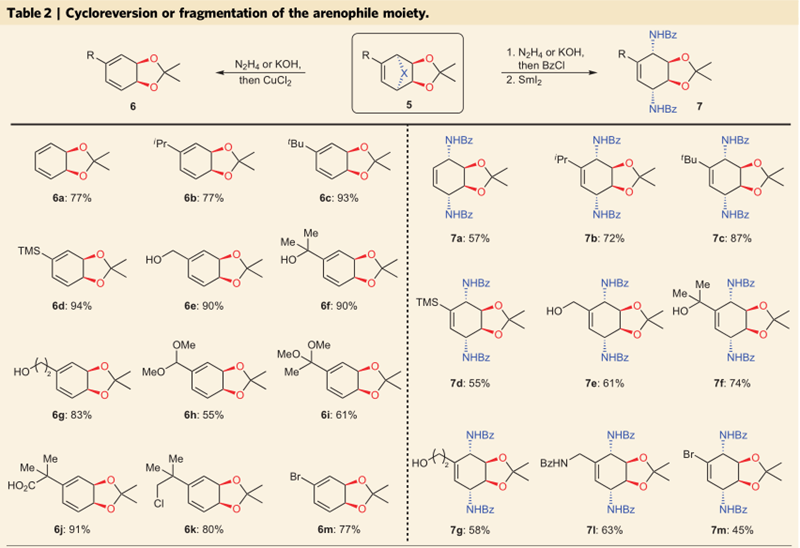
图4. 去芳香化后的中间体5的衍生化。图片来源:Nature Chem.
除了单核的芳环苯,其它多核芳环如萘、氮杂蒽、菲等都可以在可见光激发下和亲芳香体A2发生去芳香化反应,进而双羟化并在镍催化剂存在下肼解得到二胺基化二羟基化产物9,产率中等到优良,卤素、缩酮等官能团都可以兼容。
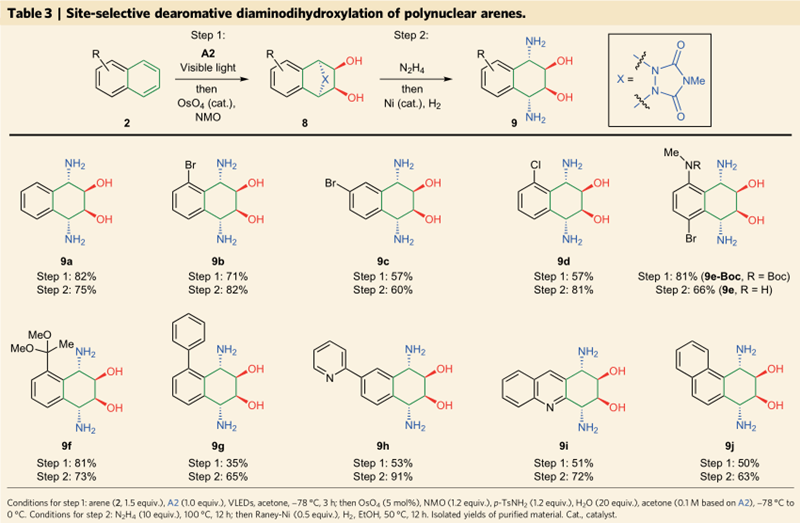
图 5 多核芳烃的去芳香化
接着,作者还把该去芳香化策略用于了三个小分子的合成,从产物5a出发,一锅法连续发生肼解再杂DA反应,以83%的收率得到化合物19,锌、醋酸条件下切断氮氧键再在三氟乙酸条件下脱去保护得到Conduramine A,两步产率78%。从6e出发,TBS保护苄醇,接着双羟化得到化合物12,最后三氟乙酸条件下脱去TBS保护和缩酮保护以94%的产率得到MK7607。从6m出发,先在OsO4、NMO条件下发生双羟化,接着和烯炔化合物15发生Sonogashira偶联,最后脱保护得到3-O-desmethyl phomentrioloxin。

图6. 去芳香化策略在合成中的应用。图片来源:Nature Chem.
总结:
David Sarlah课题组开发了一种对于简单芳烃去芳香化官能团化(双羟化或者双羟化双胺化)的策略,该策略的显著特点包括利用可见光对亲芳香体的激发,对于亲芳香体和芳烃环加成产物的原位双羟化以及环加成产物的逆环加成或者碎裂化。该策略具有广泛的底物适用性,包括常规的化学方法不能去芳香化的底物如卤代的芳烃以及苄位带有杂原子的芳烃,也能得到那些生物氧化不能得到的去芳香化氧化产物。除了单核的芳环苯及其衍生物以外,该策略还适用于多核芳烃,具有较好的产率和官能团容忍性。最后,作者还把该策略用于了三个小分子的合成,体现了其简洁高效的特点。目前,David Sarla教授课题组还在进行着底物的进一步扩展以及该反应的应用扩展,可以预见,该去芳香化官能团的策略一定会在有机合成领域具有广泛应用。
David Sarlah教授课题组主页:http://www.sarlahgroup.com/
http://www.nature.com/nchem/journal/vaop/ncurrent/full/nchem.2594.html
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
英雄所见略同,化学也有“撞衫” ——近期两篇JACS文章赏析 2015-11-29
-
《德国应用化学》报道不对称催化研究领域新进展 2016-03-16
-
钯催化的芳基脲烯烃化/去芳香化反应合成亚胺的方法学研究 2016-04-22





































 京公网安备 11010802027423号
京公网安备 11010802027423号