镍催化不对称氢化α-脱氢氨基酸酯的研究
手性α-氨基酸是一类应用非常广泛的手性分子,同时也是许多手性药物的合成骨架和重要中间体,其中过渡金属催化的α-脱氢氨基酸酯的不对称氢化反应是合成手性α-氨基酸及其衍生物最有效的方法之一。长期以来,该不对称氢化反应的催化剂多依赖于铑、钌、铱等稀有金属,相比之下,铁、钴、镍等丰产金属因其价格低廉、储量丰富、毒性较低和环境友好等优点而更具有大规模生产手性分子的潜在优势。但是基于丰产金属催化的α-脱氢氨基酸酯的不对称氢化反应报道较少,且存在反应活性较低、催化剂用量较大以及底物适用性局限等问题(图1)。

图1. 不同金属催化不对称氢化α-脱氢氨基酸酯
上海交通大学的张万斌(点击查看介绍)课题组长期致力于过渡金属的不对称氢化研究,包括稀有金属钌、铑、铱和钯的不对称催化氢化研究(钌:Chem. Commun., 2018, 54, 13571; Adv. Synth. Catal., 2019, 361, 1146; 铑:Angew. Chem. Int. Ed., 2015, 54, 2260; Org. Lett., 2018, 20, 108; Angew. Chem. Int. Ed., 2019, 58, 11505; 铱:Angew. Chem. Int. Ed., 2014, 53, 1901; Angew. Chem. Int. Ed., 2013, 52, 2203; 钯:Angew. Chem. Int. Ed., 2013, 52, 11632; Angew. Chem. Int. Ed., 2016, 55, 8444; Nat. Commun., 2018, 9, 5000),以及丰产金属镍和钴的不对称氢化(镍:Angew. Chem. Int. Ed., 2019, 58, 7329; 钴:Angew. Chem. Int. Ed., 2019, 58, 15767)。其中,该课题组利用丰产过渡金属镍实现了N-磺酰亚胺的不对称催化氢化,取得非常优异的对映选择性和反应活性。因此设想是否可以利用镍催化α-脱氢氨基酸酯的不对称氢化反应,为大规模合成应用广泛的手性α-氨基酸提供一种更为高效、廉价且清洁的路线。
研究人员首先对反应底物保护基和手性配体进行了筛选和优化,发现在氮原子上有o-Meo-C6H4取代的底物和(S)-DM-MeO-BIPHEP为配体条件下可高活性和高对映选择性地获得手性产物(表1)。

表1. 不对称氢化反应条件优化
在优化的条件下,具有不同取代基的α-脱氢氨基酸酯化合物均可取得很好的收率和对映选择性(图2)。

图2. 手性α-氨基酸酯的合成
文章通过对金属与配体配位情况的研究和对催化剂的筛选,进一步提高了催化体系的反应效率(图3)。

图3. 配位平衡
接下来研究人员对反应的实用性进行了研究。在催化剂与底物比例在1/2000的条件下实现了克级规模反应,以98%的收率和92%的对映选择性获得手性α-氨基酸酯产物,产物再与Schwartz试剂反应后进行一步水解即可制备手性保持的手性α-氨基酸。同时,产物在硼氢化锂还原后经酸性脱保护也可制备应用广泛的手性β-氨基醇分子(图4)。
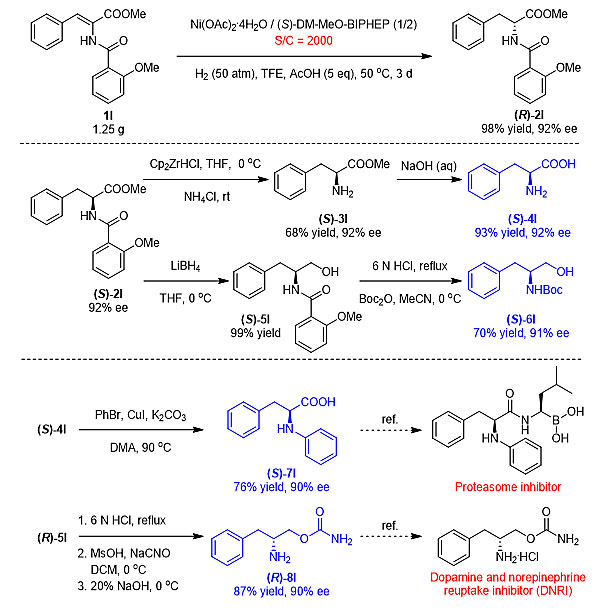
图4. 衍生应用
最后,本文通过氘代实验和化学计算推测了该反应的催化机理(图5)。
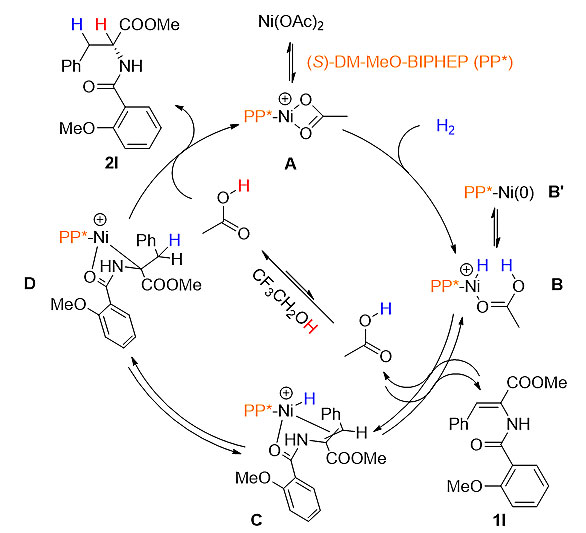
图5. 催化循环机理研究
总结
上海交通大学张万斌课题组以丰产金属镍为催化体系首次高效地实现了α-脱氢氨基酸酯的不对称氢化反应。该催化体系具有非常优异的底物适用性,实现了S/C为2000 的克级规模反应。同时,氢化产物可以很简单地衍生合成手性α-氨基酸和β-氨基醇等重要合成中间体。这一成果最近发表在Angew. Chem. Int. Ed.上,文章的第一作者是上海交通大学药学院硕士生胡雅雯。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Nickel-Catalyzed Asymmetric Hydrogenation of 2-Amidoacrylates
Yawen Hu, Jianzhong Chen, Bowen Li, Zhenfeng Zhang, Ilya D. Gridnev, Wanbin Zhang
Angew. Chem. Int. Ed., 2020, DOI: 10.1002/anie.201916534
导师介绍
张万斌
https://www.x-mol.com/university/faculty/12592
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号