P450-BM3催化的硫氧化与羟化反应:一种共同的或两种不同的催化活性物质?
细胞色素P450酶是一类具有多种催化活性的血红素单加氧酶,可以立体选择性催化碳氢羟基化、烯烃环氧化、硫氧化等多种反应。由于在其催化循环中会涉及到活性中心血红素的多种氧化状态,这就引发了一个问题,即是存在不同活性中间体催化不同反应,还是只有一种通用的活性中间体催化所有的氧化反应?
在P450的氧化过程中,原则上,三种氧化活性中间体Cpd Ⅰ、氢过氧化铁(Cpd 0)和血红素-Fe(Ш)-H2O2都需要考虑。尽管经多年P450氧化羟基化机理的详细研究,血红素-Fe(Ⅳ)=O(Cpd Ⅰ)被一致认为是其催化活性中间体,但关于硫氧化机理的研究报道却并不多。虽然近几年的实验和理论研究已经将Cpd 0从硫氧化催化活性中间体中完全排除,但关于Cpd Ⅰ和血红素-Fe(Ш)-H2O2在P450-BM3中的反应性机理难题尚未得到完全解决。
王健博(点击查看介绍)课题组将实验研究与理论计算相结合,以P450-BM3催化不对称硫氧化和碳氢羟基化为模式反应,以刚性底物硫代色满-4-酮和1-四氢萘酮为化学探针,重新探讨了P450催化氧化的机理问题。

作者首先通过定向进化的方法,分别获得了具有单一立体选择性以及高活性催化模式反应的突变体,然后通过比较硫氧化突变体催化羟化反应以及羟化反应突变体催化硫氧化反应的活性和立体选择性,发现其中的差异,由此提出假设存在不同活性中间体催化这两种反应。接着通过过氧化氢酶的实验排除掉可能的中间体血红素-Fe(Ш)-H2O2,最后通过计算建模的方式确认在这两类反应中唯有血红素-Fe(Ⅳ)=O(Cpd Ⅰ)是催化这两类反应的活性中间体。
表1.WT、WAJ-9和A328F对1的硫氧化和3的羟基化的动力学数据。
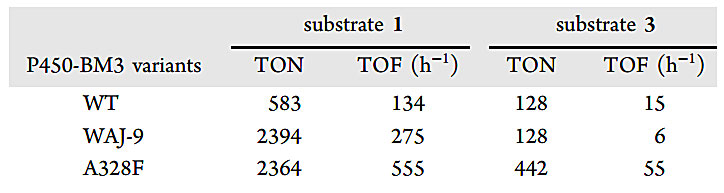
表2.过氧化氢酶存在下的动力学实验。
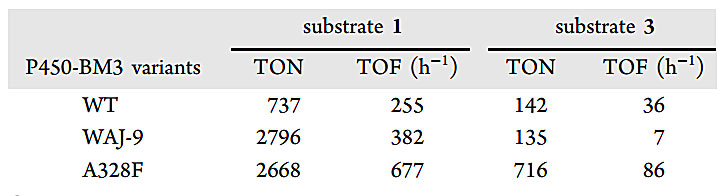
表3.实验和200 ns MD模拟得出的底物1在反应中硫氧化的对映选择性以及在底物1存在下WT、WAJ-9和A328F的Cpd I计算的平均Ox-S距离。

在该研究工作中,作者巧妙地选择了刚性底物硫代色满-4-酮和1-四氢萘酮作为化学探针,相较于之前研究所采用的柔性底物硫代脂肪酸和脂肪酸,在大的P450-BM3结合口袋中他们不会以多种不同的构象和结合模式出现,更适合用于P450酶的机理研究,而且首次通过实验手段排除了Fe(III)-H2O2作为活性物种催化反应的可能性。此外,作者还采用定向进化的手段,对P450酶进行了改造,利用高立体选择性和催化活性的突变体来进行机理的探究,更利于硫氧化和碳氢羟基化反应在实验和计算过程中的比较研究。这一研究确认了Cpd I为P450催化氧化反应的唯一物种,为以后的定向进化改造提供了有效参考。
这一成果近期发表在Journal of the American Chemical Society 上,湖南师范大学为第一单位,王健博教授为一作和通讯,博士研究生黄群为并列一作,厦门大学王斌举教授以及德国马普煤炭所Manfred Reetz教授为共同通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

P450-BM3 Catalyzed Sulfoxidation versus Hydroxylation: A Common or Two Different Catalytically Active Species?
Jian-bo Wang, Qun Huang, Wei Peng, Peng Wu, Da Yu , Bo Chen, Binju Wang, Manfred T. Reetz
J. Am. Chem. Soc., 2020, 142, 2068-2073; DOI: 10.1021/jacs.9b13061
王健博教授简介
王健博:湖南师范大学化学化工学院教授,2004年本科毕业于南开大学化学系;2010年于上海有机化学研究所取得博士学位,博士导师:唐功利研究员;2012-2014和2014-2017分别在美国埃默里大学和德国马普煤炭所做博士后研究,2017年7月正式入职湖南师范大学,研究领域为生物催化和酶的定向进化,已通讯作者身份正式发表论文5篇,含JACS 2篇,ACS Catal. 1篇。
课题组网页
https://www.x-mol.com/groups/wanglab
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号