Angew:NHC催化的不对称[3+4]环化反应,高效构建含季碳手性中心螺环
季碳手性中心在天然产物和药物分子中广泛存在,如Mesembrine、Lycoramine、常山碱与异常山碱、Haliclorensin等,但是其合成具有一定挑战性,因此一直是不对称催化领域的难点和研究热点。在构建含有季碳手性中心的合成砌块中,靛红衍生的贫电子烯烃是广大有机化学家的宠儿,如Scheme 1所示,取代基不同,反应位点也不一样(Scheme 1, a and b)。
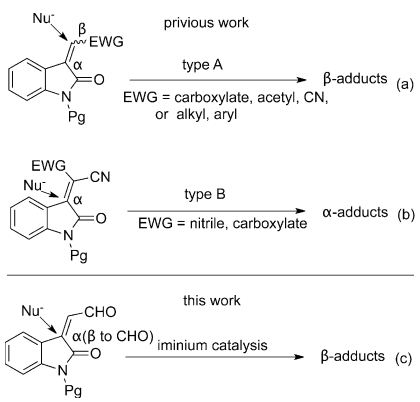
Scheme 1. Isatinderivatives in asymmetric catalysis (Chem. Eur. J., 2013, 19, 7319-7323)
2013年,华东师范大学化学系张俊良教授开创性的把靛红衍生的的α,β-不饱和醛引入到小分子催化中(Scheme 1, c),使用Jørgensen-Hayashi催化剂,分别以吲哚和丙二酸酯作为亲核试剂,高对映选择性得到含有季碳手性中心的合成砌块1-2。作者利用这两个简单的基元反应作为关键步骤,分别进行了(-)-Chimonanthine和(-)-Debromoflustramine E的全合成。
相比于靛红衍生的其它贫电子烯烃,其α,β-不饱和醛类化合物研究的很少。最近,德国亚琛工业大学化学系的Dieter Enders教授以靛红衍生的α,β-不饱和醛为底物,实现了氮杂环卡宾(NHC)催化的不对称[3+4]环化反应,高效构建了螺苯并氮杂卓酮和螺-1,2-二氮杂卓酮衍生物(Scheme 2),具有广阔的药物发现应用前景。(Asymmetric Synthesis of Spirobenzazepinones with Atroposelectivity and Spiro-1,2-Diazepinones by NHC-Catalyzed [3+4] Annulation Reactions. Angew. Chem. Int. Ed., 2016, DOI: 10.1002/anie.201604819)

Scheme 2. Synthetic strategy (Angew. Chem. Int. Ed., 2016, DOI: 10.1002/anie.201604819)
研究人员首先对催化体系进行了一系列的筛选(Figure 1),最后发现,1-氨基-2-茚醇衍生的卡宾化合物4d作为催化剂,碳酸铯作为碱,乙酸乙酯作为溶剂是合成螺苯并氮杂卓酮最佳的反应条件组合。

Figure 1. Catalyst screening (Angew. Chem. Int. Ed., 2016, DOI: 10.1002/anie.201604819)
在最佳条件下,研究人员对底物的普适性进行了考察(Scheme 3)。从结果中可以看出,产物的产率中等(49%-75%)。由于氮上有基团Ts保护,产物存在阻转异构,导致产物存在非对映选择性,其非对映选择性最高可以达到大于20/1。ee值最高可以达到98%。

Scheme 3. Substrate Scope for synthesis of spirobenzazepinones(Angew. Chem. Int. Ed., 2016, DOI: 10.1002/anie.201604819)
然而,合成螺苯并氮杂卓酮最佳的反应条件并不适用于螺1,2-二氮杂卓酮的合成。研究人员通过筛选,得到催化剂4g,TMEDA作为碱,四氯化碳作为溶剂的最佳反应条件。随后,研究人员在最佳条件下考察了底物的普适性(Scheme 4)。从结果中可以看出,该反应具有很好的底物普适性,产率最高可以达到85%,ee值最高可达到97%。该反应可以成功的进行克级制备,这证明了它的应用价值。
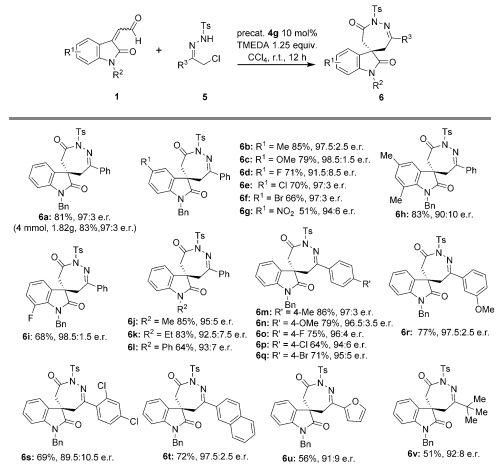
Scheme 4. Substrate Scope for synthesis of spiro-1,2-diazepinones (Angew. Chem. Int. Ed., 2016, DOI: 10.1002/anie.201604819)
作者对螺苯并氮杂卓酮进行了阻转异构研究(Scheme 5)。当使用DMSO作为溶剂,加热到90℃以上时,酰胺氮原子的阻转异构出现了构型反转。而当把保护基团Ts脱掉,或者把酰胺还原为胺时,产物的阻转异构就消失了。

Scheme 5. Thermal epimerization and loss of atropisomerism study (Angew. Chem. Int. Ed., 2016, DOI: 10.1002/anie.201604819)
作者还进行了多环螺1,2-二氮杂卓酮和螺1,2-噁氮杂卓酮的合成(Scheme 6),显示了该催化体系的广泛适用性。

Scheme 6. Polycyclic spiro-1,2-diazepinone and spiro-1,2-oxazepinone synthesis (Angew. Chem. Int. Ed., 2016, DOI: 10.1002/anie.201604819)
随后研究人员提出了如Scheme 7所示的催化循环。

Scheme 7. Proposed mechanism (Angew. Chem. Int. Ed., 2016, DOI: 10.1002/anie.201604819)
总结:
作者报道了利用靛红衍生的α,β-不饱和烯醛作为底物,实现了氮杂环卡宾催化的不对称[3+4]环化反应,高效构建了含有季碳手性中心的螺苯并氮杂卓酮和螺-1,2-二氮杂卓酮衍生物,为具有潜在药物活性的手性分子提供了一种高效的合成方法。
参考文献:
1. R. Liu, J. Zhang, Chem. Eur. J., 2013, 19, 7319-7323
2. R. Liu, J. Zhang, Org. Lett., 2013, 15, 2266-2269
http://onlinelibrary.wiley.com/doi/10.1002/anie.201604819/full
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号