《Nature》:血红素换个“心”,催化大不同
酶是以高效率和高选择性而著称的天然生物催化剂,它是大自然最精巧的创造之一。不过纯天然的酶原本是服务于生命体系的,催化反应的种类有限。人工合成的催化剂当然应用范围更广,不过酶的优越特性又实在不忍舍弃,这种时候喜欢不信邪的化学家就要大显身手啦。这不,加州大学伯克利分校(UC Berkeley)的John F. Hartwig教授瞄上了血红蛋白。

John F. Hartwig教授是国际著名有机化学家,2012年当选美国科学院院士,现年52岁,重点是很帅。
图片来源:University of California, Berkeley
血红蛋白的一大特征是拥有Fe-卟啉IX(Fe-PIX)辅因子,原始的血红蛋白可以催化C-H键氧化和卤化反应,并且可以成功地应用于非生物底物。而以Fe-PIX为核心的其他酶,可以催化卡宾、氮宾与烯烃或X-H键的插入反应(X = N, S)和端芳香烯烃的环丙烷化,但对不活泼的C-H键和烯烃的类似反应则无效。
在以往的研究中,科学家已经发现对于一些反应,小分子Ru/Rh/Ir-卟啉的催化效果远好于Fe-卟啉分子,于是他们在想,用这些贵金属代替这些酶中的铁能否收到奇效?
这个想法并非首创,实际上Mn/Cr/Co核心的“血红蛋白”已经被报道过,只是它们的催化活性都不如Fe-PIX,对Ru/Rh/Ir核心的催化效果,John F. hartwig团队的成员心里也没底。(Abiological catalysis by artificial haem proteins containing noble metals in place of iron. Nature, 2016, DOI: 10.1038/nature17968)
计划的第一步是要合成出相应金属核心的酶。已有的方法包括组合法和单一表达法。组合法需要先用酸把血红蛋白的结构打破,释放出Fe-PIX后,再使空的血红蛋白(apo-PIX)折叠回原样。之后再与不同的M-PIX(M为各种金属)混合,得到产物后分离纯化。这一过程非常繁琐,产率低下。另一种单一表达法比较简单,直接表达出M-PIX核心的蛋白,但几乎每一种金属都要换一个表达方法,缺乏普适性,效率依旧不高。于是本文的研究人员开发了一种新的表达系统。
他们尽量降低大肠杆菌培养基中铁盐的含量,以抑制血红素的合成,并保持较低的温度使apo-PIX蛋白保持稳定。最终他们得到了含铁量低于5%的apo-PIX蛋白。这些蛋白与不同的M-PIX混合,填补蛋白中的空位,便能得到不同的M-PIX蛋白。
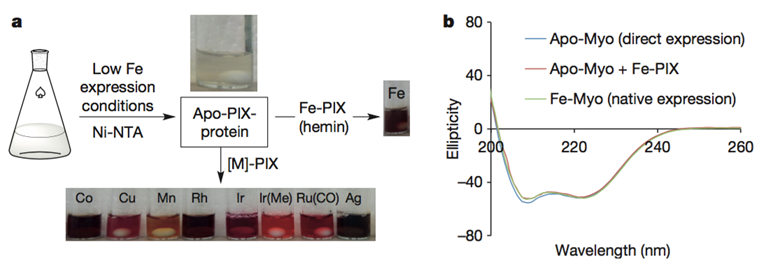
M-PIX蛋白制备过程。圆二色光谱表明细菌中表达的apo-PIX蛋白、加铁后的蛋白与天然的Fe-PIX蛋白在构象上没有差别。图片来源:NPG
获得了这些M-PIX蛋白后,研究人员比较了不同金属核心的酶催化卡宾的C-H键插入反应及芳香烯烃加成反应的活性。结果表明Ir(Me)-PIX蛋白的催化活性最好。
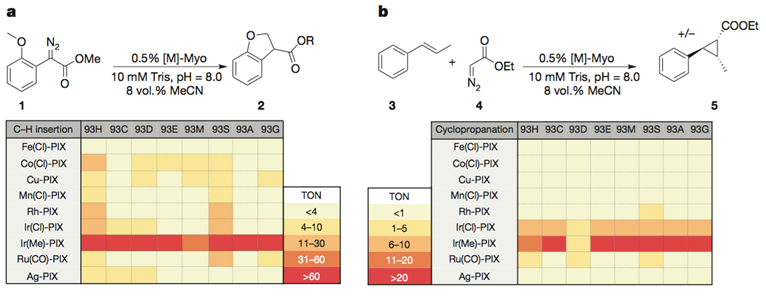
图片来源:NPG
基于此,为了获得高的对映选择性和产率,研究人员又对PIX结合位点附近的重要氨基酸逐一做了突变、筛选(93G代表蛋白质93号氨基酸为甘氨酸G)。
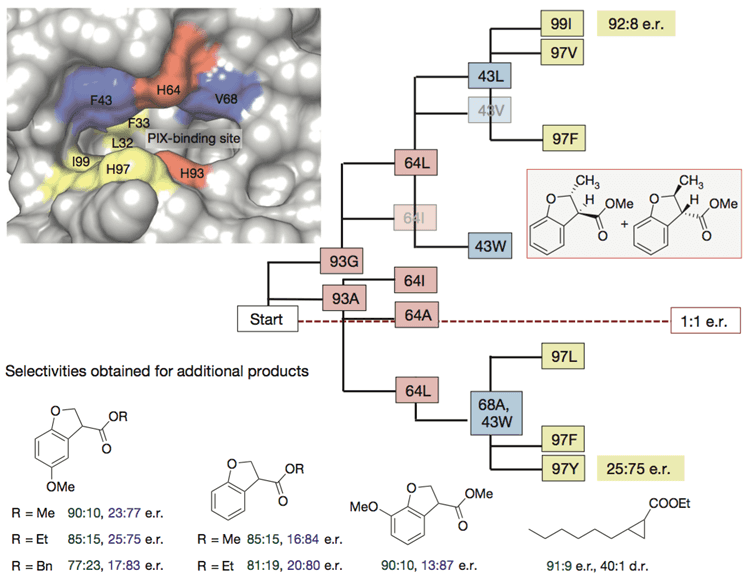
图片来源:NPG
Ir(Me)-PIX蛋白的不同突变体不仅弥补了Fe-PIX蛋白的不足,能够成功催化卡宾的C-H键插入反应和不活泼烯烃加成反应,而且对映选择性、催化剂转换数TON(单位时间内转化的底物的物质的量/催化剂的物质的量)都相当不错。
氘评:
这项简短有力的工作虽然还不够完美,在底物耐受性、产率、选择性、催化效率、机理研究等方面还有很大进步空间,但无疑打开了人工改造天然酶催化剂的新思路。仅仅是把自然界存在的酶换一个金属核心,就能对新的化学反应产生催化功能,不知道是大自然故意给人类留下了发挥空间,还是化学家足够机智呢?
http://www.nature.com/nature/journal/vaop/ncurrent/full/nature17968.html
(本文由氘氘斋供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号