《Nature Chem.》:自由基取代实现芳环对位C-H键官能团化
最近几年C-H键活化领域非常活跃,成果也非常突出。化学家们一般使用导向基团或者设计特殊底物实现选择性C-H键活化。在芳香环体系人们陆续实现了邻位和间位C-H键活化,而专一性地实现对位C-H活化的报道还非常少。
近期的《Nature Chemistry》报道了哈佛大学的新生代牛人化学家Tobias Ritter教授课题组通过电荷转移导向的自由基取代反应,高选择性地实现芳环对位C-H键活化。传统的观点认为自由基取代反应在芳环体系中的选择性很难控制,而Ritter教授报道的电荷转移策略打破了以往的认知,为这类反应提供了一个新的思路。(Charge-transfer-directed radical substitution enables para-selective C–H functionalization. Nature Chem., DOI: 10.1038/nchem.2529)
芳香取代反应历史悠久,是人们得到芳基取代物常用的方法,但很多时候都得到了混合物(Figure 1a);后来人们发展了过渡金属催化的C-H键活化反应,能够以很好地选择性得到邻位或者间位产物(Figure 1b),而得到对位产物的报道却比较少;Ritter教授使用高亲电性地自由基TEDA2+·,实现芳环对位C-H键活化(Figure 1c)。
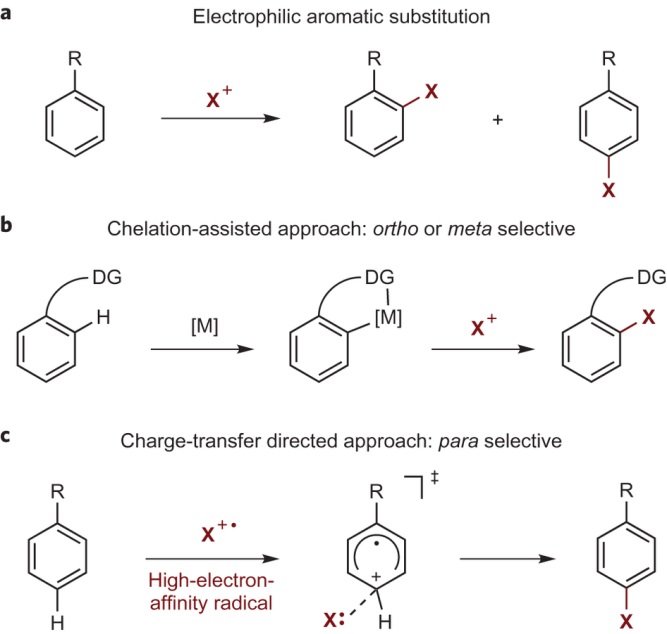
Figure 1. From: Nature Chemistry
研究小组使用的高亲电自由基TEDA2+·,由氟源Selectfluor在Pd催化剂1和Ru(bipy)3(PF6)2作用下得到。该方法在烷基C-H键活化领域早有报道,而芳环体系的应用还是首次报道。TEDA2+·与氟苯反应能够高选择性地得到对位取代的产物2a(Figure 2a),主要因为TEDA2+·具有较高的电子亲和电势12.4 eV(DFT计算),与单取代芳环的对位加成时能够得到能量最低的过渡态(Figure 2b)。反应位点与能否最大化地扩散中间体的电子云密度有关;Fukui亲核参数能够很好地预测不同底物的反应位点(Figure 2c)。
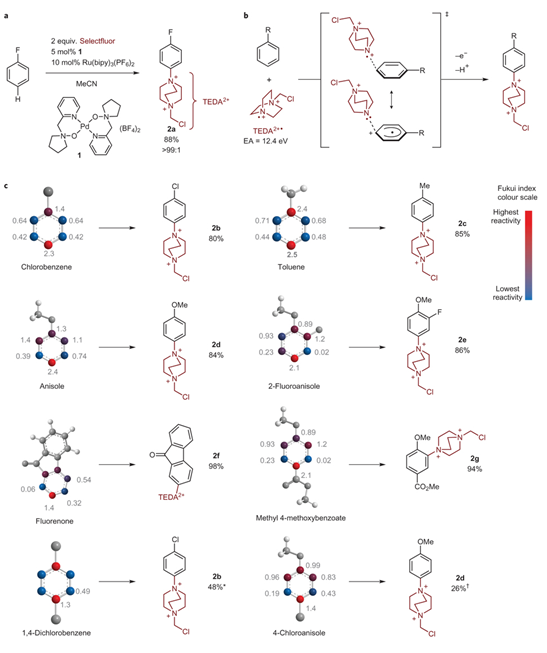
Figure 2. From: Nature Chemistry
研究小组总结文献中不同自由基的电子亲和电势以及反应选择性。一般中性自由基的电子亲和电势在0.8-3.6 eV之间,远低于TEDA2+·,而芳基取代反应中使用中性自由基往往仅得到很低的选择性,例如苯基自由基(1.1 eV)与氟苯反应时邻间对比例仅为47:16:37;邻苯二甲酰亚胺自由基(3.7 eV)邻间对比例为37:11:52;哌啶自由基正离子的电子亲和电势为7.7 eV,其邻间对选择性提高到11:10:79;而本文使用的双正离子自由基TEDA2+·电子亲和电势最高,达到12.4 eV,仅得到了对位取代的产物(Figure 3)。随着电子亲和电势的增加,反应选择性也相应提高。
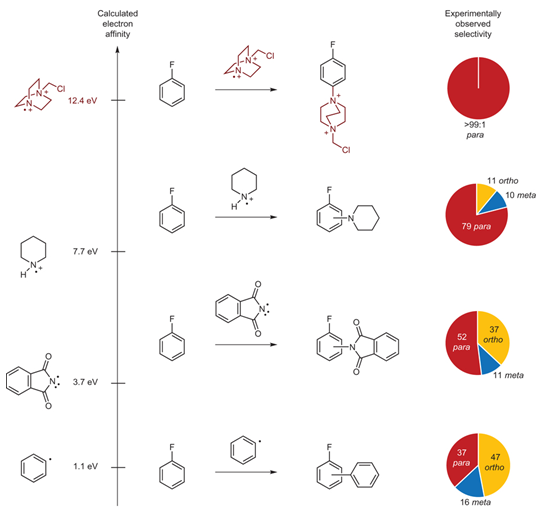
Figure 3. From: Nature Chemistry
随后研究小组对反应底物进行了拓展,并实现了两步一锅法得到芳基哌嗪类化合物(Figure 4)。很多单取代、双取代芳环或者杂芳环类化合物都能够很好地得到对位加成产物。首先利用C-H键活化得到Ar-TEDA产物,然后在硫代硫酸钠作用下得到芳基哌嗪类化合物。哌嗪类化合物子在医药、材料中有着广泛的用途。
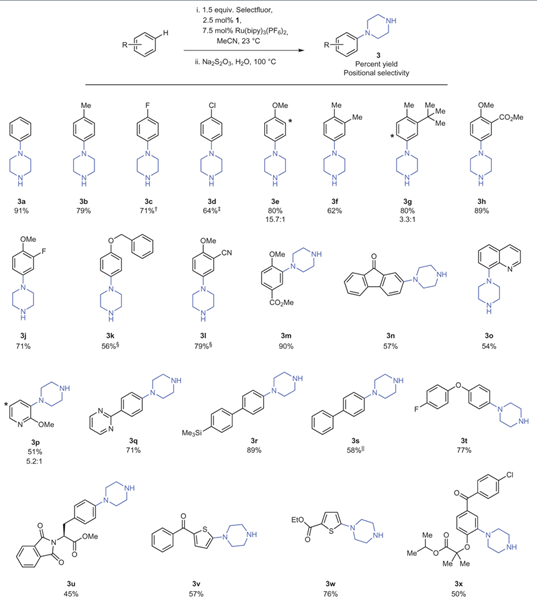
Figure 4. From: Nature Chemistry
总结:
Ritter教授报道了专一性地得到对位加成产物的方法:使用Selectfluor得到双正离子自由基TEDA2+·,与芳环专一性地得到对位加成产物,并一锅法得到哌嗪类化合物。该方法还使人们对自由基取代反应在芳环中的应用有了新的认识。
http://www.nature.com/nchem/journal/vaop/ncurrent/full/nchem.2529.html
Ritter教授小组链接:
http://rittergroup.org/ (马普研究所)
http://www.kofo.mpg.de/en/research/organic-synthesis (马普研究所)
(本文由moonlight供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!





















































 京公网安备 11010802027423号
京公网安备 11010802027423号