《Science》再发老方法的新思路,两“老试剂”携手构建手性芳香含氮杂环
目前已知的活性药物分子中,有近90%含有一个或多个芳香性杂环基团,大多数杂环中的大部分含有氮原子。在合成这种杂环分子的过程中,连接两个碳原子是其中的一个关键步骤,但大家都知道形成碳碳键(C-C键)可不容易,经常需要中间步骤,这使得合成工艺较长效率较低。另外,许多与药物相关的杂环分子是具有手性的,不同异构体的活性甚至差别很大,这就意味着需要一种方法来创建正确的手性中心。
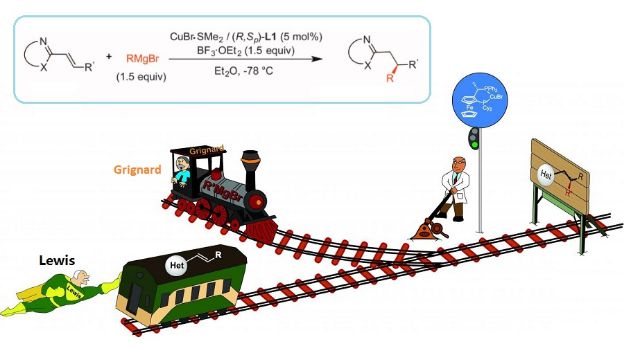
近日X-MOL报道了Baran实验室 “从老方法里找新思路”的两篇重量级文章(《Nature》文章、《Science》文章),这一策略最近似乎变得很流行,荷兰的格罗宁根大学的合成有机化学家Syuzanna Harutyunyan团队也从老方法中找到了新思路来解决手性芳香含氮杂环的构建问题,更轻松和更精确地合成对药物开发非常重要的手性含氮杂环化合物。她们在《Science》上报道了她们的研究成果,利用了有机化学领域里两种具有百年历史的老技术,将带有β取代共轭烯基的芳香含氮杂环转化成其相应的手性烷基化产物(见下图),反应具有高度的对映选择性和化学选择性。(Catalytic asymmetric addition of Grignard reagents to alkenyl-substituted aromatic N-heterocycles. Science, DOI: 10.1126/science.aaf1983)
图片来源:Juan F. Collados/University of Groningen
Harutyunyan和她的团队所用的是历史悠久又赫赫有名的“格氏试剂(Grignard reagents)”及“路易斯酸(Lewis acids)”。格氏试剂最初由1912年首位诺贝尔化学奖得主Victor Grignard发明,至今仍是构建碳碳键的重要工具。路易斯酸得名于另一位有机化学先驱Gilbert N. Lewis,与Grignard同时代的他提出了著名的“路易斯酸碱理论”。
“不过,这些相对稳定的芳香含氮杂环化合物并没有直接与格氏试剂反应,”Harutyunyan说。这时,路易斯酸就派上了用场。路易斯酸可以吸引自由电子对,通过“拉”走电子,让很多分子更具反应性。Harutyunyan需要一个非常强的路易斯酸来激活这些杂环分子。那么问题又来了,格氏试剂是一种碱,和路易斯酸放在一起会发生反应,这就会使这两种试剂都失去作用。

Syuzanna Harutyunyan博士(右)。图片来源:University of Groningen
Harutyunyan之前的研究结果表明,低温或许能路易斯酸和格氏试剂和平相处。Harutyunyan说,“我花了很多时间来研究这些试剂的特性,这些结果给了我启发,在零下78摄氏度的条件下把这两种试剂结合起来使用。”实验证明她的想法是对的,在低温下的格氏试剂和路易斯酸的混合物能够活化与杂环相邻的碳原子,并产生碳碳键。另外,研究人员添加了带手性配体的铜催化剂,以提供手性选择性。
零下78摄氏度的温度对于制药公司来说有点低,而且这个温度下所用的溶剂是醚类,“这对于工业界来说太过易燃了,”Harutyunyan说。经过优化,该团队可以在零下50摄氏度的条件下使用较温和的甲苯作为溶剂进行反应。
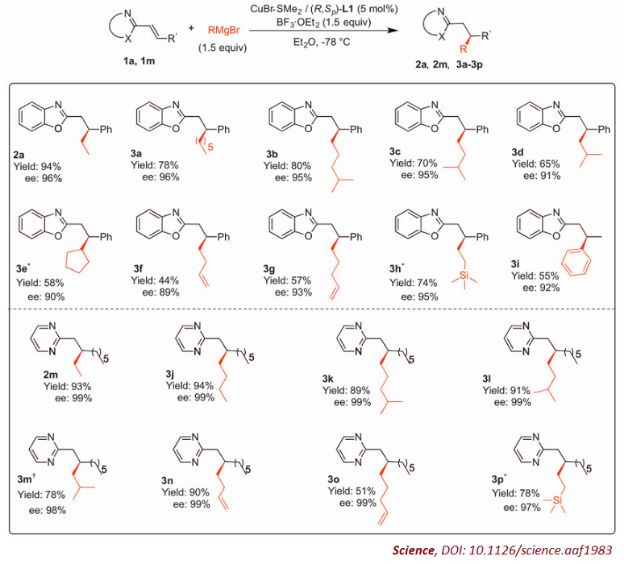
除了对映选择性和化学选择性让人满意之外,这个简单的反应可以为芳香含氮杂环引入的基团范围十分广泛,包括线性烷基、支链烷基、环烷基以及苯基。
制药公司已经表示对Harutyunyan的方法产生了兴趣。Harutyunyan 说,“对于药物发现来说,你需要合成先导化合物的各种衍生物。这一策略使得此种合成工作更容易实现。”
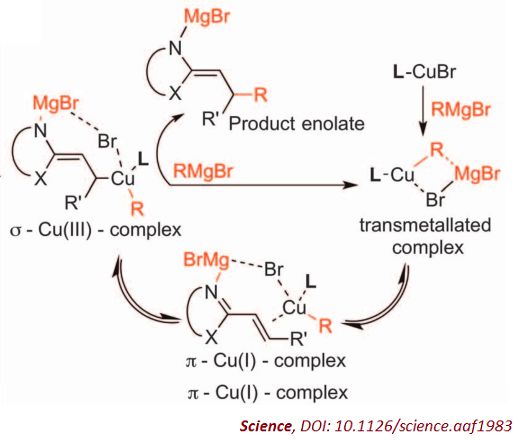
反应的可能机理
同时,该团队正在研究路易斯酸与格氏试剂究竟如何在这一条件下起作用。“我喜欢研究机理,只有搞清楚反应究竟如何发生,才可以改进它们。”Harutyunyan说,她希望将反应温度提高到零下40摄氏度或更高,“这样工业界更容易接受”。
1. http://science.sciencemag.org/content/352/6284/433
2. http://www.rug.nl/news/2016/04/_cool_-combination-produces-easier-carbon-bonds
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号