Nature:美女教授16步首次合成(+)-perseanol
Ryanodane和isoryanodane类天然产物是具有高度氧化态的二萜,对于半翅目和鳞翅目害虫具有拒食和杀灭效果。Ryanodine(1)是第一个从Ryania speciosa Vahl 中分离得到的这类化合物,并且R. speciosa木材粉作为植物性杀虫剂曾在上个世纪50年代早期年产量一度达到200吨。有研究表明ryanodine的杀虫活性可能与其作用于ryanodine受体(RyR)后调节Ca2+释放有关。因此,2000年后RyR作为防治害虫的靶点引起了学术界和工业界的广泛兴趣,其中邻苯二甲酰胺和邻氨基苯甲酰胺作为RyR的变构抑制剂在2016年销售超过10亿美元。
Ryanodane类天然产物ryanodine拥有高度拥挤的[6-5-5]笼状稠环体系(下图),曾引无数合成化学家“竞折腰”,大多合成超过30步,直到2016年加州理工学院(Caltech)的美女教授Sarah E. Reisman课题组才用15步完成了(+)-ryanodol的全合成(Science, 2016, 353, 912)。而作为其骨架异构体,(+)-perseanol(3)则是[5-6-5]笼状稠环体系,于1996年从加那利群岛的灌木Persea indica中分离得到(J. Agric. Food Chem., 1996, 44, 296)。尽管缺乏RyR高亲和性的吡咯-2-甲酸酯基团,但(+)-perseanol也表现出对鳞翅目害虫很高的拒食活性,并且相比Ryanodine来说对哺乳动物毒性更小。目前尚未有证据表明(+)-perseanol是否作用于RyR,因此开发高效的合成路线以提供足够量的化合物对于阐明其作用机制是大有裨益的。在这个背景下,近日Sarah E. Reisman教授课题组从简单的长叶薄荷酮(R)-(+)-pulegone出发仅用16步就完成了(+)-perseanol的全合成,相关成果发表在Nature 上。
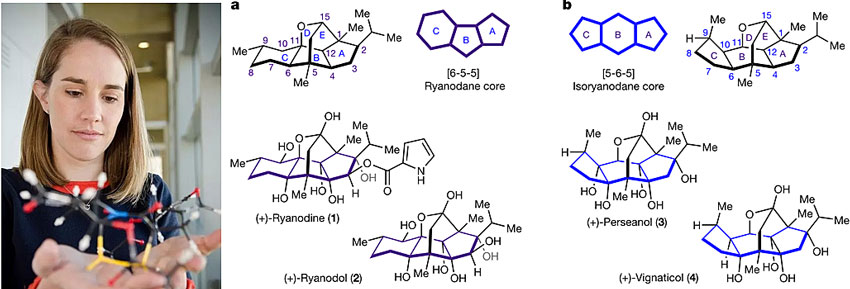
Sarah E. Reisman教授及ryanodane和isoryanodane类天然产物。图片来源:Caltech / Nature
从结构上看,(+)-perseanol的合成无疑存在着很大的挑战(下图),比如七元桥内酯环和两个含有syn-二醇的季碳单元。研究人员认为要想简洁地合成该化合物,必须采用战略性的方式引入6个羟基以最少化保护基和氧化态的操作。根据之前合成(+)-ryanodine和(+)-ryanodol的经验,逆合成分析认为(+)-perseanol可以通过5的双键环氧化/还原环化制备,后者可以通过关键中间体6的氧化得到。而6的内酯环则可以通过8发生钯催化的6-exo-trig环化/羰基化串联反应得到,8则是金属化的A环片段9和C环片段10通过1,2-加成得到。
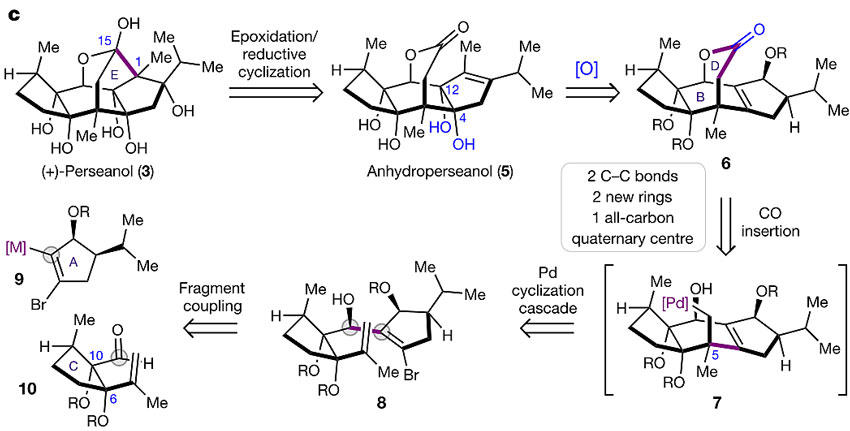
逆合成分析。图片来源:Nature
C环片段的合成从(R)-(+)-pulegone开始(下图),通过一步已报道的氧化缩环(溴对双键加成后重排)得到非对映异构体混合物12,被KHMDS烯醇化后暴露在O2/P(OMe)3中得到醇13 (d.r. = 9:1),然后在m-CPBA下发生羟基导向的环氧化生成14,后者用二乙基铝2,2,6,6-四甲基哌啶(Et2Al(TMP))处理得到syn-二醇15,其构型与产物C6-C10上羟基构型一致。用苯亚甲基缩醛保护二醇后经DIBAL还原酯基成醇17,然后用铜催化的氧化条件得到醛18,该片段总共只经过6步反应且可以克级制备。
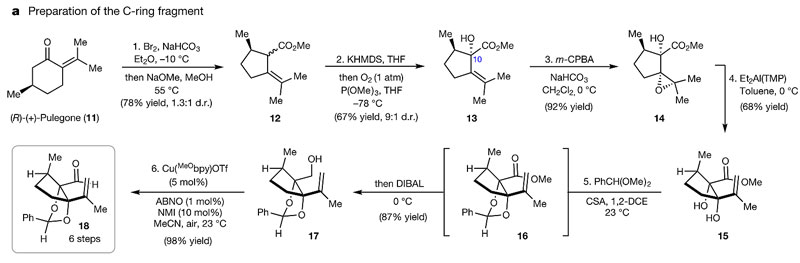
C环片段的制备。图片来源:Nature
A环片段从商品化的烯酮19开始(下图),通过烷基化后得到21再在I2/硝酸铈铵作用下得到碘代物22,氢氧化钠水解后得到二酮23接着用草酰溴进行溴化得到24。中间体24为外消旋体,可以通过Corey–Bakshi–Shibata条件进行动力学拆分以91%的ee 值得到醇27,然后经PMB保护得到A环片段29。
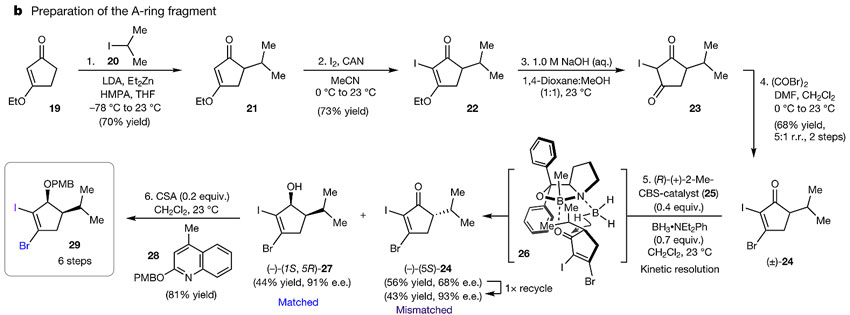
A环片段的制备。图片来源:Nature
在拿到上述两个片段后,(+)-perseanol的全合成之旅才开始进入高光时刻(下图)。29通过选择性的锂-碘交换后与醛18发生1,2-加成得到30(d.r. = 3.2:1),后者在Pd(PPh3)4/N-甲酰基糖精催化体系下发生6-exo-trig环化-羰基化串联反应后被羟基捕获得到四环骨架31。值得一提的是,这一转化并不容易,起初作者尝试用催化量的钯催化剂,但如果在CO气氛中反应几乎得不到31,他们推测CO与钯配位导致无法对双键进行氧化加成。当预先将30和化学计量的钯源搅拌足够长的时间(90 min)后再通入CO(1 atm足够,加大压力影响不大)就能以52%的收率得到31。这一现象也引起了研究人员进一步思考:将CO维持在低浓度也许可以降低钯催化剂用量。果然,利用N-甲酰基糖精作为CO源,只需要50 mol%的Pd(PPh3)4就能以57%的收率得到31。该步在形成七元内酯环的同时,不仅同时构建两个C-C键,并且立体控制优秀,是本全合成步骤中最大亮点。
四环骨架31经DDQ脱去PMB保护后经DMDO氧化成酮38,出乎意料的是苯亚甲基缩醛竟被氧化成羟基苯甲酸酯。在CeCl3•2LiCl存在下,38与MeMgCl发生1,2-加成得到含有isoryanodane所有碳骨架的醇39,后者在TFA作用下发生邻基参与的1,3-烯丙基迁移反应得到原苯甲酸酯41。而这些巧妙的转化看上去只是通过苯亚甲基缩醛这个保护基调控的。中间体41再经过烯丙位C-H键氧化和羟基导向的环氧化就能得到43。接下来需要发生5-endo-tet环氧开环才能构筑四氢呋喃环,而这一过程是不符合Baldwin环化规则的。尽管文献有报道称在Brønsted或Lewis酸性条件下含有导向基团的底物可以稳定环氧锂中间体以实现endo-型的开环反应,但43明显不能耐受。因此,研究人员开始尝试用未曾报道过的中性或偏碱性的条件。之前他们曾用LiDBB实现过该反应并完成(+)-ryanodine的全合成,但对43却效果很差,主要是发生原苯甲酸酯被还原的竞争反应。换成萘锂可以17%的收率得到环化产物46,而更弱的还原剂蒽锂则只能发生环氧异构化,最终研究人员发现2-苯基萘锂在苯/四氢呋喃混合溶剂中可以25%的分离收率得到46。最后用Pd(OH)2/H2条件脱去保护基就能完成(+)-perseanol的全合成。
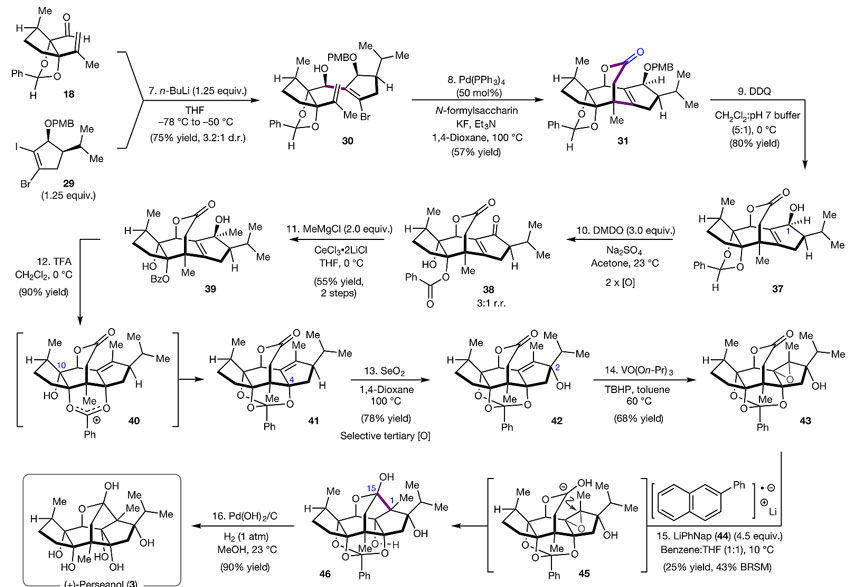
(+)-perseanol全合成。图片来源:Nature
总结
基于巧妙的逆合成分析,尽量减少氧化还原步及保护基使用,Sarah E. Reisman教授课题组以16步实现对(+)-perseanol的首次全合成,其中关键步钯环化羰基化的探索和顺利实现是笔者以为的最出彩之处。顺便八卦一下,Caltech的Sarah Reisman教授和UIUC的M. Christina White教授一直是笔者认为在有机合成界的两位美貌与智慧并重的“女神”。如今Reisman教授对(+)-perseanol的首次全合成就实现了16步的简洁路线,笔者不仅要为后来者能否超越捏一把汗。任何评论都已多余,只剩膜拜!
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A 16-step synthesis of the isoryanodane diterpene (+)-perseanol
Arthur Han, Yujia Tao, Sarah. E. Reisman
Nature, 2019, 573, 563-567, DOI: 10.1038/s41586-019-1580-x
导师介绍
Sarah E. Reisman
https://www.x-mol.com/university/faculty/466
撰稿:峰千朵
审校:龙须友
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号