来了!又一固定剂量免疫治疗在我国获批,深度揭秘PD-1抑制剂固定剂量背后的科学逻辑
本文获“奇点网”授权转载,版权归“奇点网”所有,任何转载需获得“奇点网”授权。
中国的癌症免疫治疗时代,已经扑面而来。
在过去的一年半时间里,国家药品监督管理局(NMPA)接连批准了5款PD-1抑制剂,它们分别对应4个癌种的7个适应症。还有不少新的适应症的上市申请已经获得NMPA的批准。可以想象得到,在接下来的时间里,免疫治疗必然会覆盖更多的患者。
可能很多朋友跟奇点糕一样,在看到这几款PD-1抑制剂的使用剂量时,心里有个大大的疑问:为什么有的是按照体重给药,有的是不分体重,所有患者使用同一种固定的剂量?有些药物,两种给药剂量方式同时存在?
随之而来的问题是:不同使用剂量的疗效一样么?副作用如何?
今天,奇点糕就以已经在我国同时获批3 mg/kg按体重给药,以及240 mg固定剂量给药方式的纳武利尤单抗(nivolumab)为例,和大家聊聊肿瘤免疫药物剂量确立背后的故事。
先按体重来
要搞清楚前面那些问题,我们先得从PD-1抑制剂的使用剂量是如何确定的开始说起。
在新药的研发过程中,临床前的动物和人体细胞实验是非常重要的一步。通过这一步科学家可以知道新药有没有按照预计的方式起效,毒性如何,尤其是对人体的各种细胞类型。还有就是初步了解药物的起效浓度。
有了这个初步的数据,下一步就是开展临床研究了。
在临床研究阶段,科学家有两个大问题需要考虑:一个是药物代谢动力学(PK),另一个是药物效应动力学(PD)。

药物代谢动力学(来源:eupati.eu)
药物代谢动力学,往简单了说就是研究药物进入人体之后主要去哪儿了,被什么组织吸收了,怎么没的,以及在血液中随时间的变化规律等问题。而药物效应动力学,则是探索药物在人体的内是如何发挥作用的,治疗效果如何,以及不良反应这些问题的。
2006年,霍普金斯大学医学院的科学家发起了全球范围内第一个免疫检查点抑制剂的临床试验[1],用于评价的nivolumab对癌症患者的安全性、耐受性等PKPD数据。
通过这个研究,研究人员确定了以下几个问题:即使是10 mg/kg的用量,也没有达到最大耐受剂量;即使nivolumab在血清中的浓度低到检测不到的水平(<1.2 μg/ml),仍能保持对血液中T细胞上的PD-1做到70%以上的占有率,而且这种占有率到85天之后才开始衰退。
在这个研究的基础上,名为CA209-003的I期临床研究在2008年启动了。这项迄今为止在该领域内随访时间最长的研究,主要探索的是nivolumab分别以1 mg/kg、3 mg/kg和10 mg/kg的给药剂量,用于经治非小细胞肺癌的疗效和安全性。
通过该研究,基本敲定以3 mg/kg,每两周给药一次的治疗方,来作为nivolumab今后在多种实体瘤的统一给药剂量[2]。这个剂量随后在黑色素瘤[3],非小细胞肺癌[4,5],肾癌[6]的III期临床研究中纷纷得到确认。
在确定以体重给药的同时,为了便于患者,nivolumab的包装分40 mg和100 mg两种规格。经这两种规格的不同组合就能满足不同体重患者的用药需求。
永不止步
除了按体重确定给药剂量之外,近几年对固定剂量给药方式的探索一直在进行。固定剂量,顾名思义,就是不管患者体重如何,都统一使用同一个剂量。
那么这个固定剂量是如何算来的?与按体重给药相比效果和安全性又如何呢?
为了选择合适的nivolumab固定剂量,研究人员分析了34个nivolumab临床研究涉及的3458名患者数据。发现所有患者的基线体重范围在34-180 kg之间,中位体重为77 kg[7]。因此,研究人员用3 mg/kg乘以80kg,得到的240 mg作为固定的给药剂量,给药频率是每两周给药一次。
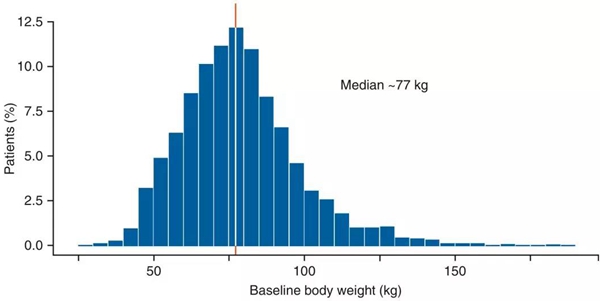
(图:患者的中位体重)
显然,对于体重为80 kg的患者而言,240 mg给药量产生的药物暴露,与3 mg/kg给药量产生的暴露是一致的。
不过,鉴于药物代谢动力学与体重之间的关系,固定给药剂量是否意味着体重在中位体重之下的患者会承受较高的nivolumab暴露,而体重在中位体重之上的患者则会承受较低的nivolumab暴露呢?这是否会产生安全性问题或者影响疗效呢?
科学家自然想到了这一点,因此着重进行了探索:之前已有研究表明,nivolumab即使是10 mg/kg的给药量也没有达到患者的最大耐受量。而在一个较宽的体重范围内(35-160 kg)的受试者使用每两周一次240 mg固定剂量,nivolumab 的总暴露与3 mg/kg每两周一次相似。
考虑到 nivolumab的药物代谢动力学与体重的关系,尽管预计固定剂量将使体重较轻患者的暴露相对于体重较重患者为高,但该方案预测暴露的中位值和95百分位数仍将很好地保持在低于10 mg/kg每两周一次时的水平[2]。因此,240 mg这个固定给药剂量对于几乎所有的患者来说,都是足够安全的。

两种剂量的安全性比较
据此,研究人员预计在黑素瘤、非小细胞肺癌和肾细胞癌患者中,nivolumab的3 mg/kg与240 mg用药剂量的死亡风险(OS)相似,安全性与有效性也相似。因此,与3 mg/kg每两周给药一次的方案相比,使用240 mg每两周给药一次的固定剂量,对于体重高于中位体重的患者而言,效果也不会改变[7]。
在这一确定过程中,群体药代动力学(PPK)研究发挥了重要作用。PPK是经典的PK模型与群体统计学模型结合分析,通过定量考察个体间变异、个体自身变异等患者群体中药物浓度的决定因素,为制定更加合理有效的临床给药方案提供全面量化的信息,是药学领域公认的一种剂量探索模式。
果然不负众望,nivolumab以240 mg每两周给药一次的固定剂量,通过了PPK模型的考察。
正是基于严格的理论测算和数据分析,FDA早在2016年就批准了nivolumab以固定剂量240 mg每两周给药一次的使用方法[8]。
240 mg给药量的成功确立,让研究人员对更长周期的给药方案充满了信心。理论上讲,在保证获益和安全性的前提下,延长给药周期对于医疗资源使用和提升患者长期依从性都是大有益处的。于是,研究人员继续探索480 mg每四周给药一次的固定剂量。

PPK模型
与证明240 mg安全性和有效性的方法类似,研究人员也证实了480 mg每四周给药一次的给药方案的安全性和有效性。不出所料,2018年3月6日,FDA批准nivolumab的480 mg每四周一次的固定剂量给药方案,几乎覆盖了当时所有已经获批的适应症[9]。
240 mg和480 mg的固定给药剂量之所以能获得批准,除了效果和安全性与3 mg/kg的给药方式一致之外,还有一些比较实际优点,对于医护人员来讲,固定剂量使用配药更方便,由此能大大减少中间环节带来的出错可能;对于患者来讲,则能避免药物浪费,提高经济性,延长了的给药周期还大大方便了长期用药[10]。
中国人群的固定剂量探索
不过,240 mg的固定剂量是基于西方患者的80 kg平均体重得出来的,对于中国患者60kg的平均体重而言,240 mg或者360 mg的剂量一样安全有效吗?
首先可以确认的一个问题是,即使是在中国人群中,240 mg的固定剂量仍远远小于10 mg/kg给药的暴露量。而之前的研究已经证实,10 mg/kg是安全的,没有达到人体最大耐受剂量。尽管如此,固定剂量在中国人群中的安全性和有效性仍然受到了足够的重视。
2015年,CheckMate 077研究开展,这项旨在专门探索中国人群nivolumab剂量的研究由中山大学肿瘤医院张力教授牵头。
在这项I/II期临床研究中,研究人员招募了鼻咽癌等其他实体瘤患者。探索每两周3 mg/kg、每两周240 mg、每三周360 mg的用药方式,在中国人群中的耐受情况。
研究结果在今年5月份发表在The Oncologist杂志上,结果验证了240 mg和360 mg固定剂量的给药方式,同3 mg/kg的按体重给药方式一样,都在中国患者中耐受良好,免疫原性低,与全球数据一致[11]。如果可供选择的给药剂量和周期变得更丰富——这对于中国患者来说无疑是个好消息。
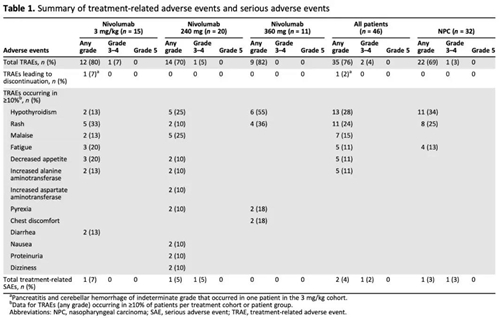
240mg和360mg给药量在中国患者群体中的安全性
值得一提的是,目前正在开展的专门针对我国晚期非小细胞肺癌患者的CheckMate 870研究[12],nivolumab就是以240 mg固定剂量,每两周进行给药的,并且输注时间缩短到了30分钟。
这一大型III期研究计划招募约470名经治的晚期/转移性非小细胞肺癌患者。该研究的最大亮点是充分考量我国患者的实际特点,例如乙肝病毒携带、EGFR突变等因素。对这项研究有兴趣的朋友,可以去Clinictrail.gov查看详细信息,或是继续关注奇点糕后续的叨叨。
就在上个月,国家药品监督管理局(NMPA)批准了nivolumab治疗在接受含铂类方案治疗期间或之后出现疾病进展,且肿瘤PD-L1表达阳性的复发性或转移性头颈部鳞状细胞癌患者。
我们欣喜的发现,随该适应症的获批,也增加了纳武利尤单抗240 mg固定剂量30分钟输注的用法。至此,纳武利尤单抗在按公斤体重计算的3 mg/kg用量之外,还能以240 mg固定剂量使用,在提升便利性的同时提供给医患双方更多的选择。
注:纳武利尤单抗在中国大陆仅获批非小细胞肺癌和头颈部鳞癌相关适应证。
参考资料:
[1].Brahmer J R, Drake C G, Wollner I, et al. Phase I Study of Single-Agent Anti–Programmed Death-1 (MDX-1106) in Refractory Solid Tumors: Safety, Clinical Activity, Pharmacodynamics, and Immunologic Correlates[J]. Journal of Clinical Oncology, 2010, 28(19): 3167-3175. DOI:10.1200/JCO.2009.26.7609
[2].Topalian S L, Hodi F S, Brahmer J R, et al. Safety, Activity, and Immune Correlates of Anti–PD-1 Antibody in Cancer[J]. The New England Journal of Medicine, 2012, 366(26): 2443-2454. DOI:10.1056/NEJMoa1200690
[3].Robert C, Long G V, Brady B, et al. Nivolumab in Previously Untreated Melanoma without BRAF Mutation[J]. The New England Journal of Medicine, 2015, 372(4): 320-330. DOI:10.1056/NEJMoa1412082
[4].Brahmer J R, Reckamp K L, Baas P, et al. Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer.[J]. The New England Journal of Medicine, 2015, 373(2): 123-135. DOI:10.1056/NEJMoa1504627
[5].Borghaei H, Pazares L, Horn L, et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non–Small-Cell Lung Cancer[J]. The New England Journal of Medicine, 2015, 373(17): 1627-1639. DOI:10.1056/NEJMoa1507643
[6].Motzer R J, Escudier B, Mcdermott D F, et al. Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma[J]. The New England Journal of Medicine, 2015, 373(19): 1803-1813. DOI:10.1056/NEJMoa1510665
[7].Zhao X, Suryawanshi S, Hruska M, et al. Assessment of nivolumab benefit–risk profile of a 240-mg flat dose relative to a 3-mg/kg dosing regimen in patients with advanced tumors[J]. Annals of Oncology, 2017, 28(8): 2002-2008. DOI:10.1093/annonc/mdx235
[8].https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm520871.htm
[10].Sheng J, Srivastava S, Sanghavi K, et al. Clinical Pharmacology Considerations for the Development of Immune Checkpoint Inhibitors[J]. The Journal of Clinical Pharmacology, 2017. DOI:10.1002/jcph.990
[11].Ma Y, Fang W, Zhang Y, et al. A Phase I/II Open‐Label Study of Nivolumab in Previously Treated Advanced or Recurrent Nasopharyngeal Carcinoma and Other Solid Tumors[J]. The oncologist, 2019, 24(7).
[12].https://clinicaltrials.gov/ct2/show/NCT03195491?term=CheckMate+870&draw=2&rank=1
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号