Angew. Chem.:内源性生物正交激活DNAzyme用于细胞内的金属离子成像
金属离子在生物体内分布和浓度与多种疾病的发生密切相关,其浓度会随着生命过程的变化而有所不同。为了理解金属离子在人类健康与疾病关系中发挥的作用,时空维度可控的金属离子传感器得到了广泛地研究。脱氧核糖核酶(DNAzyme)是一种在金属离子协同存在情况下的具有催化功能的 DNA序列,对金属离子具有极高的选择性。通过成熟的体外筛选技术,DNAzyme现已被广泛用于各种离子的体外检测,近年来,DNAzyme在检测细胞内的金属离子方面也得到了发展。
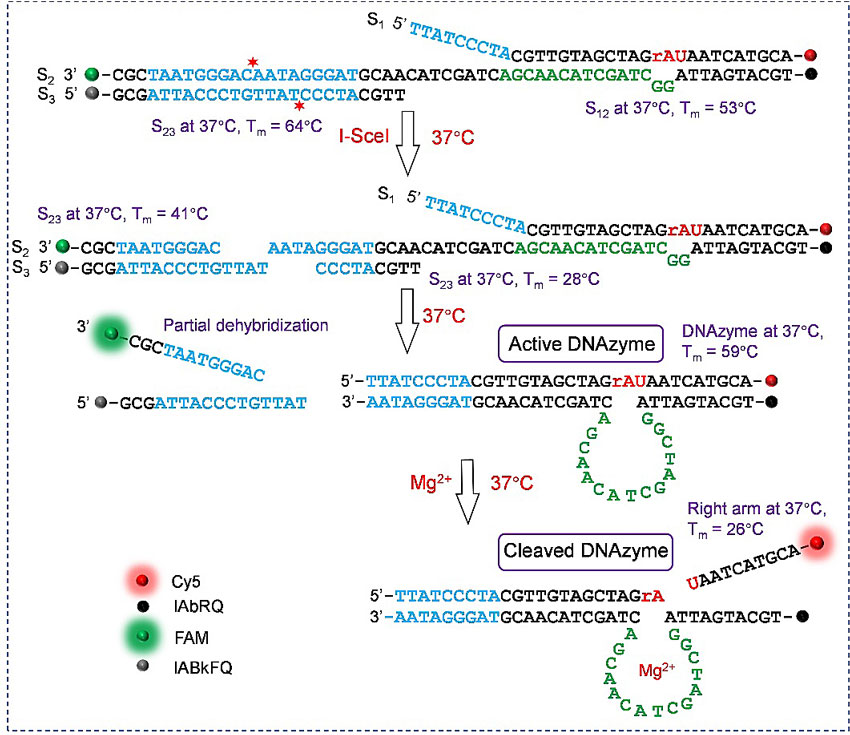
为了进一步实现细胞内金属离子的准确检测,已有多种激活DNAzyme方法被成功用于时空维度上的精准成像分析。其中包括光照切割DNAzyme保护基团或是光热形成DNAzyme的方式,但这些方法涉及到复杂的光敏保护团和纳米材料的合成,所需的紫外光照对生物体有较强的光毒性,难以穿透生物体表皮。因此,有必要构建内源性激活DNAzyme方法以克服上述的限制。近期报道的利用细胞内不同活性氧也可实现DNAzyme的激活,但在细胞内金属离子成像分析时也不可避免地加入额外的活性氧物质。
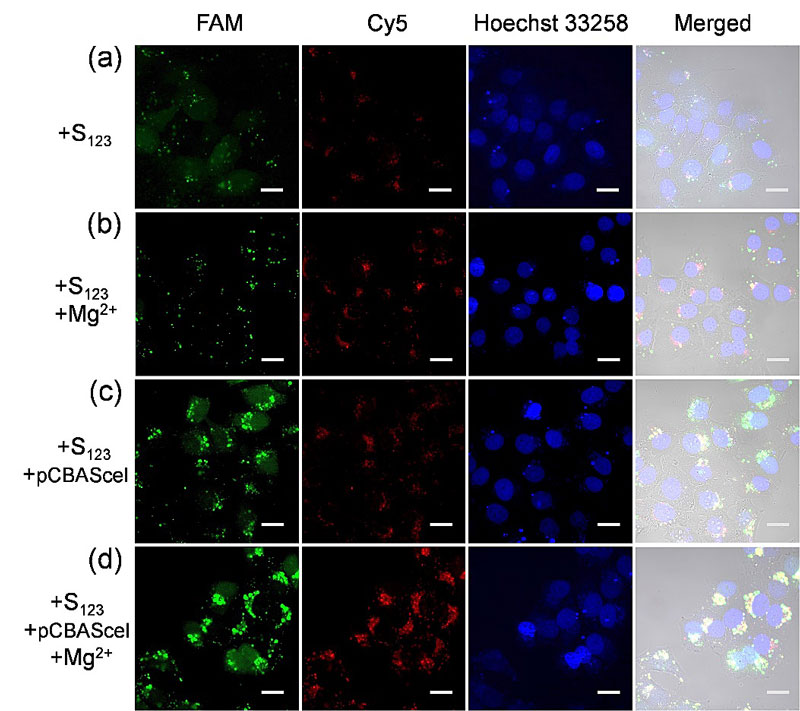
近日,美国伊利诺伊大学香槟分校(UIUC)的陆艺(Yi Lu)教授(点击查看介绍)研究团队与四川大学化学学院的郑成斌教授(点击查看介绍)研究团队合作,报道了一种基于内切酶的生物正交激活DNAzyme方法并用于细胞内金属离子检测,实现了从外源性到内源性激活DNAzyme的转变。该项研究设计的三链探针延长了DNAzyme中的酶链,并引入了能被内切酶(I-SceI)特异性识别的18 个碱基对序列,延长的DNAzyme酶链与底物链部分杂交,从而构建了包括内切酶识别位点但不具有初始DNAzyme活性的探针结构。内切酶(I-SceI)一旦在细胞体内表达,就会特异性切割探针中的识别位点,变化的杂交链熔点温度会促使DNAzyme的形成。内切酶(I-SceI)具有较长的识别位点(18 bp),在7×1010 bp的基因序列中仅仅只有一个相同的序列存在,该性质保证了内切酶在体内表达后与细胞内环境兼容。探针到达细胞后,内源性且生物正交的方法会激活探针形成具有活性的DNAzyme,进而实现细胞体内金属离子的成像分析。以该研究为基础,有望进一步通过编辑表达内切酶的质粒控制内切酶具体的表达位置,从而实现细胞中特定位置的金属离子分析。
相关研究成果发表在Angewandte Chemie International Edition上,文章的第一作者是四川大学的博士研究生林瑶,郑成斌和陆艺教授为文章的共同通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enzyme-Mediated Endogenous and Bioorthogonal Control of a DNAzyme Fluorescent Sensor for Imaging Metal Ions in Living Cells
Yao Lin, Zhenglin Yang, Ryan J. Lake, Chengbin Zheng, Yi Lu
Angew. Chem. Int. Ed., 2019, DOI: 10.1002/anie.201910343
导师介绍
郑成斌
https://www.x-mol.com/university/faculty/12785
陆艺
https://chemistry.illinois.edu/yi-lu
https://www.x-mol.com/university/faculty/188
(本稿件来自Wiley)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






































 京公网安备 11010802027423号
京公网安备 11010802027423号