《细胞》子刊:只需睡4小时的基因被找到了!华人科学家又发现一个短睡基因,携带者每天只需睡4到6小时,就能精力满满
本文获“奇点网”授权转载,版权归“奇点网”所有,任何转载需获得“奇点网”授权。
美好的周末转眼又到了快结束的时候了,两天的懒觉过后,又到了要早早起床,挤着地铁去上班的日子了。怎么样,有没有感到一丝痛苦。
但对于一些天赋秉异的人来说,这都不是事。因为他们根本不需要那么多睡眠,每天早早起床依然可以精力满满,天生适合996。
说是天赋嘛,当然来自基因。近日,加州大学旧金山分校的Guangsen Shi、Louis Ptáček和傅嫈惠等发现了迄今为止第二个短睡基因——突变的ADRB1。携带这种基因突变的人,每天只需要睡4~6小时。该研究发表在Neuron上[1]。

(来自pixabay.com)
据说,一个人一生有三分之一的时间是在睡眠中度过的。按照80岁的寿命来计算的话,躺在床上的时间几乎要有10000天。所以说,买一张好床是很有必要的。
不过,也总有些人看起来跟铁打的似的,天天晚睡早起还能精力充沛。比如达芬奇,传说每天的睡眠时间不到2小时,着实让边写稿边打哈欠的奇点糕羡慕嫉妒。
要说期末考试前打个鸡血,通宵复习,奇点糕倒也经历过。但之后嘛,夸张点说,整个暑假都睡过去了。那些人到底是怎么天天打鸡血的?

早上喝咖啡提神?人家不需要
(来自pixabay.com)
在2009年,傅嫈惠的团队确认了第一个短睡家族,他们携带的突变DEC2基因是人类所发现的第一个短睡基因[2]。这一家族中,只要是突变DEC2基因的携带者,平均每晚睡6.25小时就能精力满满,而非携带者却平均需要8.06小时。也就是说,这个短睡的DEC2基因是一个显性基因。
在这之后,陆续又有50余个一天只需不到6.5小时睡眠的短睡家族被确认。十分稀有的DEC2突变并不足以解释所有的天生短睡者。这次,傅嫈惠的团队对一个编号为K50025的短睡家族进行了研究。
通过SNP连锁分析和全外显子测序,研究人员发现,这个短睡家族中,突变的是ADRB1基因。这个ADRB1同样是个显性基因,携带ADRB1突变的人,平均每晚只需要睡5.7小时,而不携带者平均需要7.9小时,差了2个多小时。按都是80岁寿命算的话,足足多了7年的清醒时间。
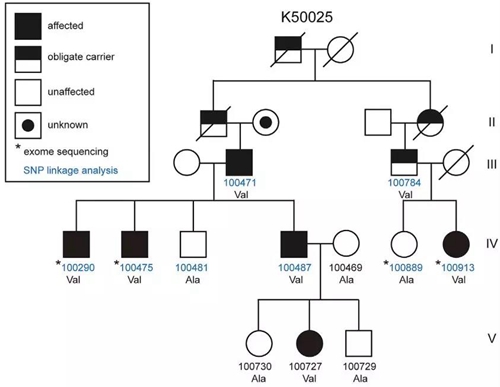
K50025家族的遗传谱系图
这个ADRB1基因,位于10号染色体长臂上,编码的是肾上腺素β1受体(β1AR),也就是美托洛尔这类降压药的靶点。ADRB1基因的突变,使得携带者的β1AR中187位的丙氨酸变成了缬氨酸。这样的突变,大约每10万人中只有4.028个。
在大脑中,去甲肾上腺素能信号一直被认为参与了睡眠的调节[3],尤其是β受体,与清醒和快速眼动睡眠(REM)有关[4]。临床上,也确实发现了β受体阻滞剂类的药物有可能引起失眠[5]。
不过,突变的ADRB1又是怎么减少携带者的睡眠需求的呢?研究人员发现,ADRB1突变后,形成的突变β1AR蛋白的稳定性显著下降,受激动剂刺激产生的第二信使cAMP也显著减少了。这不就相当于天生自带β1受体阻滞剂嘛。

来自pixabay.com)
小鼠中,杂合突变的ADRB1让小鼠在24小时内的睡眠时间比野生型的少了55分钟。尤其是在黑暗期,快速眼动睡眠少了7分钟,而代表深睡眠的非快速眼动睡眠(NREM)少了53分钟。
在野生型小鼠中,ADRB1阳性的神经元分布于海马、外侧隔核等区域,包括与睡眠相关的背侧脑桥(DP区)[6]。DP区中的ADRB1阳性神经元在不同睡眠状态下有着不同的活动状态。清醒和快速眼动睡眠时,ADRB1阳性神经元活动十分活跃,而到了非快速眼动睡眠阶段,ADRB1阳性神经元就不活动了。
在NREM向REM或清醒状态转换前,这些神经元的活动就开始增强了。而在REM向NREM或清醒状态转换前,它们的活动减弱。如果在小鼠NREM睡眠期间,人为地刺激ADRB1阳性神经元,可以立即唤醒小鼠,但对于REM睡眠期间的小鼠没有作用。
DP区的ADRB1阳性神经元促进了清醒!
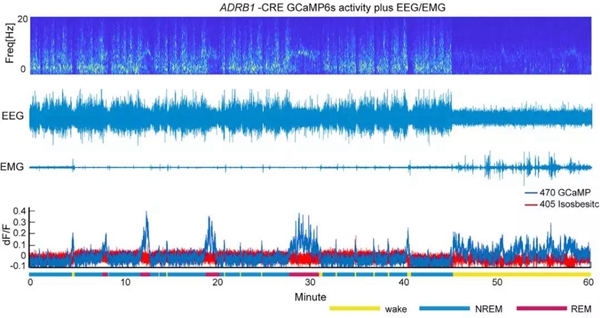
RB1神经元在清醒和快速眼动睡眠期间活跃
进一步的研究表明,突变了的ADRB1改变了ADRB1阳性神经元的电生理特性,使它们受到的抑制减小,活性更强。也就更能保持清醒了。
接下来,研究人员计划研究ADRB1在大脑其它区域中的作用,并在其他短睡家族中继续寻找更多的短睡基因。Ptáček表示:“睡眠很复杂,我们不认为大脑中有一个基因或区域在告诉我们的身体该睡觉或醒来。这只是许多部分中的一部分。”
至于这些天生短睡者的身体健康问题,傅嫈惠说:“自然短睡眠者的睡眠质量和效率更高。研究人员发现,他们往往更乐观,更有活力,更擅长一心多用。甚至一些研究人员认为他们能活得更长。”
参考文献:
1. Shi G, Xing L, Wu D, et al. A Rare Mutation of β1-Adrenergic Receptor Affects Sleep/Wake Behaviors[J]. Neuron.
2. He Y , Jones C R , Fujiki N , et al. The Transcriptional Repressor DEC2 Regulates Sleep Length in Mammals[J]. Science, 2009, 325(5942):866-870.
3. Berridge C W. Noradrenergic modulation of arousal.[J]. Brain Research Reviews, 2008, 58(1):1-17.
4. Craig W. Berridge a , Brooke E. Schmeichel a , Rodrigo A. España b. Noradrenergic modulation of wakefulness/arousal[J]. Sleep Medicine Reviews, 2012, 16(2):187-197.
5. Scheer F A J L , Morris C J , Garcia J I , et al. Repeated Melatonin Supplementation Improves Sleep in Hypertensive Patients Treated with Beta-Blockers: A Randomized Controlled Trial[J]. Sleep, 2012, 35(10):1395-1402.
6. Cox J , Pinto L , Dan Y . Calcium imaging of sleep–wake related neuronal activity in the dorsal pons[J]. Nature Communications, 2016, 7:10763.
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号