《科学》:P53蛋白真是邪了门了!哈佛科学家发现,错义突变的P53本身没有促癌活性,但能干扰正常P53的抑癌活性,促进肿瘤的发展
本文获“奇点网”授权转载,版权归“奇点网”所有,任何转载需获得“奇点网”授权。
作为肿瘤界最大的明星基因,p53的抑癌能力可谓无人不知,无人不晓。最耳熟能详的便是其在超过50%的肿瘤中都发生了突变。
其实,这个大明星的作用并非大家想象的那么简单。
最初被鉴定出来时,p53便被人们当做一个促癌基因。后来人们才慢慢发现,p53具有强大的抑癌作用[1]。
但是,事实的真相远非如此,不时有传言:一些错义突变会使P53蛋白会化身恶魔,推动癌症发展[2],绝非仅仅是失去功能!
如果这个传言是真的,这意味着药物研发的思路也要调整,开发针对P53突变蛋白的抑制剂或许才是正确的选择。
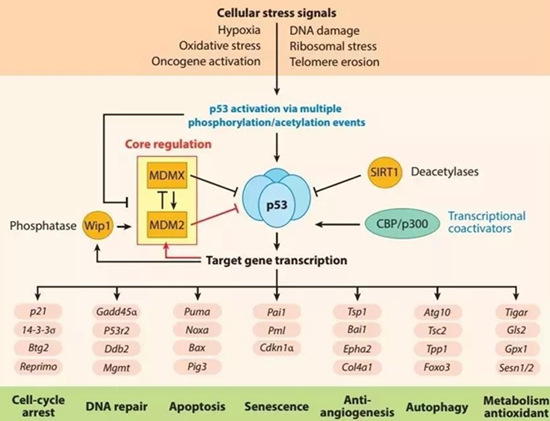
最近,哈佛大学的研究团队,终于解开了p53基因身上各种错义突变的含义。他们在急性髓性白血病(AML)细胞中发现,原来,这些错义突变真的仅仅是让P53蛋白失去了功能,进而影响其他正常功能的P53蛋白,发挥了显性负效应的作用。这会推动AML以及骨髓增生异常综合征(MDS)的发展。
并且,研究人员还通过基因编辑技术,对p53基因上可能出现的7860种错义突变,逐一进行了研究,揭示了它们真正的作用,可以指导后续的探索。相关研究发表在顶级学术期刊《科学》上,论文的通讯作者是Benjamin L. Ebert教授,第一作者是Steffen Boettcher博士[2]。

Ebert教授(图片来自哈佛大学)
科学家曾发现,带有p53突变的AML或MDS患者的预后极差,常常能抵抗化疗,并且在接受造血干细胞移植后有很高的复发风险[4-6]。
有人怀疑,可能这些突变让P53蛋白从抑癌蛋白变成了促癌蛋白,不过,一直没有证实。
为了搞清楚这些突变的作用。研究人员先是挑出了p53基因上最常见的6个错义突变,在AML细胞中进行了研究。
他们将这些错义突变和完全缺失突变以及功能正常p53基因进行了对比,发现错义突变竟然与完全缺失突变一样,都能抵抗化疗药物道诺霉素诱导的细胞凋亡,抵御细胞毒性因子,并且无法启动细胞周期阻滞。(完全缺失突变一般是那些能够使转录提前终止的突变,使得蛋白完全失去功能)
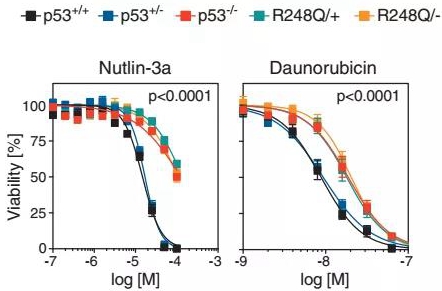
p53突变增强癌细胞的生存能力
这就很奇怪了,到底是怎么回事呢?为什么这么多错义突变都会造成功能完全缺失呢?
p53基因编码一个转录因子,控制多种基因的表达。转录因子发挥作用时,首先需要绑定到基因上,也就是它的DNA结合区域,然后再激活基因转录。
很多错义突变都在这个结合区域。他们怀疑,这些错义突变可能会破坏DNA结合区域。
研究人员仔细研究了这些突变基因编码的P53蛋白与DNA的结合情况,确实发现很多突变蛋白的DNA结合能力被破坏了。
紧接着,他们又检测了这些突变蛋白的转录激活能力,发现这些P53突变蛋白的转录催化活性也消失了。
作为一个转录因子,没有了转录催化能力,其功能自然也就丧失了,怪不得和完全缺失突变一样!
以往被忽视的错义突变,竟然有如此严重的后果,这是让人始料未及的。
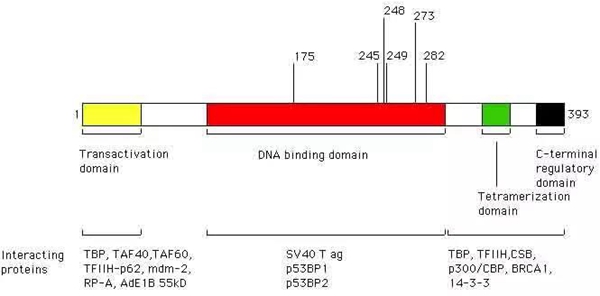
p53基因结构(图片来自bioscience.org)
随后,研究人员又在多个AML临床队列中,检测了p53基因上错义突变的分布情况。发现这些AML患者的p53基因上,大量的突变都集中在编码DNA结合结构域的序列上。并且,错义突变与完全缺失突变的侵袭性和预后相似。
既然这几个错义突变的后果很严重,那很可能有更多的错义突变也是如此。为了搞清楚更多错义突变的含义,研究人员祭出了一项法宝——CRISPR系统。
科学家们曾用这个技术诠释过大量乳腺癌风险突变的含义,现在它又来帮我们破解更广泛的p53突变的作用了。
研究人员用CRISPR系统在对造血干细胞的p53基因进行“饱和编辑”,制造了大量突变,然后转到小鼠中。
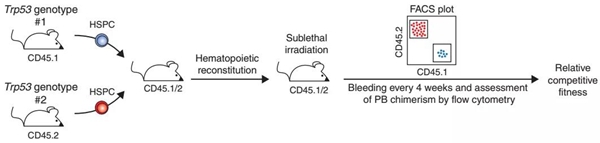
实验过程
检测发现,很多带有p53错义突变的造血干细胞的增殖能力明显增强,比正常细胞有优势,而这些错义突变往往造成了P53蛋白的功能缺失。
此外,研究人员还发现,杂合体p53突变细胞的增殖能力也明显增强,也就是说,有部分P53蛋白的功能正常,也无济于事。
原来,P53蛋白要发挥作用需要先形成四聚体。若失去功能的P53蛋白和其他功能正常的P53蛋白组成四聚体,那么这个四聚体也会没有正常功能。
也就是说,因突变而失去功能的P53蛋白,会连累那些功能正常的P53蛋白,使它们也失去功能,这种作用被称为显性负效应。
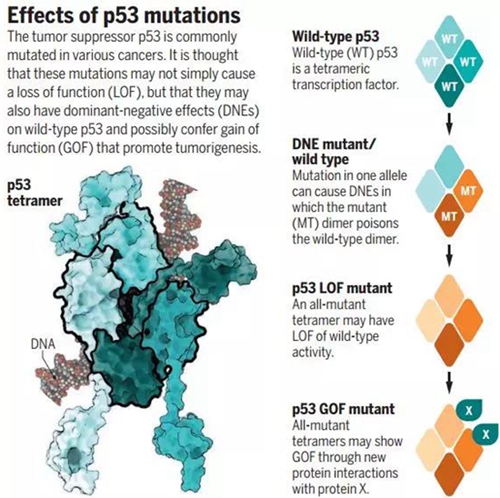
DNE,显性负效应[7]
这种显性负效应可以推动癌前病变细胞进化,对癌细胞的形成有重要作用。
由于p53突变的普遍性,这种显性负效应可能不只存在于AML中,因此,这个研究的发现可能有更广泛的意义,后面需要更深入的探索。
而这个研究可能还有更现实的作用,既然具有显性负效应的p53错义突变会影响造血干细胞的增殖,那么理清背后的分子机制,对于寻找新的治疗AML或MDS的方法具有重要意义。
参考资料:
[1] Joerger A C, Fersht A R. The p53 pathway: origins, inactivation in cancer, and emerging therapeutic approaches[J]. Annual review of biochemistry, 2016, 85: 375-404.
[2] Baugh E H, Ke H, Levine A J, et al. Why are there hotspot mutations in the TP53 gene in human cancers[J]. Cell Death & Differentiation, 2018, 25(1): 154-160.
[3] Steffen Boettcher et al. A dominant-negative effect drives selection of TP53 missense mutations in myeloid malignancies. Science, 2019, 365, 599–604. DOI:10.1126/science.aax3649.
[4] Bejar R, Stevenson K, Abdel-Wahab O, et al. Clinical effect of point mutations in myelodysplastic syndromes[J]. New England Journal of Medicine, 2011, 364(26): 2496-2506.
[5] Rücker F G, Schlenk R F, Bullinger L, et al. TP53 alterations in acute myeloid leukemia with complex karyotype correlate with specific copy number alterations, monosomal karyotype, and dismal outcome[J]. Blood, 2012, 119(9): 2114-2121.
[6] Lindsley R C, Saber W, Mar B G, et al. Prognostic mutations in myelodysplastic syndrome after stem-cell transplantation[J]. New England Journal of Medicine, 2017, 376(6): 536-547.
[7] https://science.sciencemag.org/content/365/6453/539
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






















































 京公网安备 11010802027423号
京公网安备 11010802027423号