JACS:化学网络结构分析启发下的二萜生物碱Arcutinidine的全合成
具有高度复杂三维结构天然产物的合成策略的设计极具挑战,通过逆合成分析法,减少这些复杂结构中的桥环数量,所产生的并环体系可以启发随后的断键方式。1975年,Corey教授提出了一种格式化的“逻辑”,用于桥环类骨架逆合成,它阐述了识别‘最大桥接环’的优点,通过切断最少的化学键最大程度的简化结构,此外,通过应用二键断裂(即“双环转化”),可以快速降低逆合成方向上的目标分子复杂度,在这方面,环加成反应是不可或缺的。
二萜生物碱是一大类次生代谢物,具有高度复杂的三维结构和调节电压门控离子通道的活性。这些结构非常适合化学网络分析(chemical network analysis),化学网络结构分析可以有力地简化断键方式。2015年,加州大学伯克利分校的Richmond Sarpong教授(点击查看介绍)课题组报道了Corey化学网络分析法在合成乌头碱型(aconitine-type)二萜生物碱中的应用,包括liljestrandinine(1,图1A)。类似的分析也用于了denudatine-type生物碱,如paniculamine(2)和hetisine-type生物碱cossonidine(3)的全合成。在Corey的图形分析的基础上,作者还引入了一种基于Web的图形化算法,以便于识别任意给定结构的最大桥接环。近期,他们又在J. Am. Chem. Soc.上发表文章,将化学网络结构分析应用于确定合成arcutane-type二萜生物碱arcutinidine(4)的策略。这类天然产物包括arcutine(5)、arcutinine(6)和aconicarmicharcutinium(7)(图1B)(目前有人认为,4并非天然产物,而是天然产物5、6、7的皂解产物)。
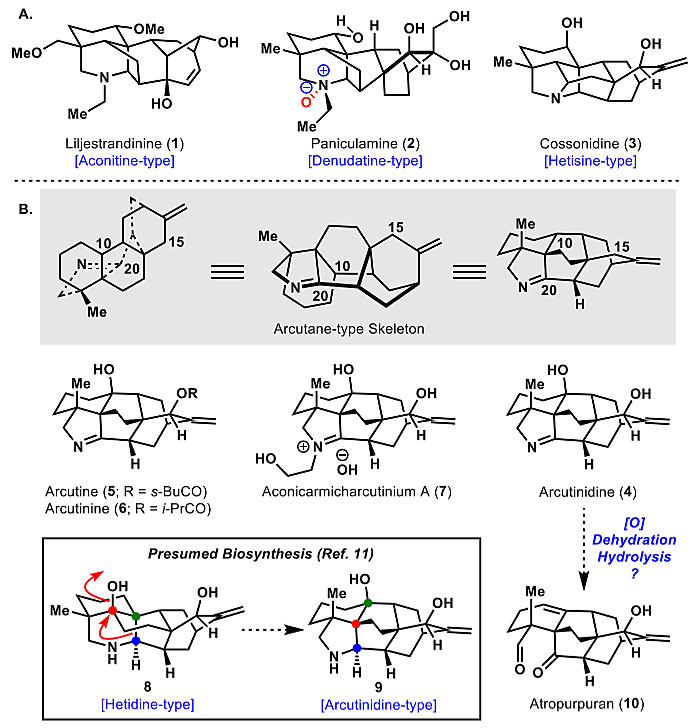
图1. 代表性的二萜生物碱及其可能的合成关系。图片来源:J. Am. Chem. Soc.
比这些天然产物骨架更吸引人的是它们的生源合成假设途径。arcutinidine(4)可能是由Hetidine骨架的氧化和重排引起的(图1B)。这种推测的阳离子引发的重排得到了作者2015年报道的计算结果的支持。这些计算结果还表明,在实验室条件下,假设的生物合成的可逆过程也有可能发生(即9到8);这种转化可以从arcutinine骨架合成出Hetidine生物碱。此外,arcutinidine 中1-吡咯啉的氧化和水解可得到相关的二萜类atropurpuran(10)。因此,arcutinidine的合成可为进一步研究atropurpuran的可能生物合成途径奠定基础,并为其他二萜类生物碱的合成提供方法。值得一提的是,近期,秦勇教授课题组也报道了对4和6的全合成(J. Am. Chem. Soc., 2019, 141, 9712–9718),随后李昂教授课题组同时报道了4、5、6的全合成(J. Am. Chem. Soc., 2019, DOI: 10.1021/jacs.9b05818)。

图2. Arcutinidine的逆合成分析。图片来源:J. Am. Chem. Soc.
在考虑4的逆合成方法时,作者希望通过应用多个环加成转化来快速降低结构复杂性。应用化学网络分析法,首先确定了两个最大的桥接环,其中一个是“主”环,另一个是“信封”环(图2)。一个关键的ex-endo键的战略性断开,逆推到前体11。可利用[4+2]双环化转化得到11,这样又逆推至四环化合物12。12可通过二烯体14和亲二烯体13的另一个[4+2]环加成得到,这一反应将形成两个相邻的季碳手性中心。在Diels-Alder反应中,阳离子亲双烯体具有更高的反应活性,但对含氧亲双烯体的环加成反应还没有先例,因此,本文的工作将有助于探索这些杂环阳离子的反应活性。作者期望的oxopyrrolium 13是通过已知的酰亚胺15和甲基烯醇醚16之间的Wittig反应以及随后的傅克环化而产生的。

图3. DA反应的计算化学分析。图片来源:J. Am. Chem. Soc.
首先,作者研究了二烯17和马来酰亚胺18之间的传统的环加成反应(图3)。根据HOMO-LUMO的分析(17的HOMO为-5.6 eV,18的LUMO为-2.4 eV),由于反应碳原子电性不匹配,反应活性和选择性较差。相反,oxopyrrolium 13(-4.3 eV)的LUMO与二烯14(-6.5 eV)的HOMO具有互补极化,将有助于更容易和更具选择性的环加成。
具体合成路线如下:酰亚胺15在PPh3和甲基烯醇醚16条件下,经改进版Wittig反应,得到非共轭烯烃,与DBU反应异构化后为所需的马来酰亚胺(18)。18与二烯化合物(17)进行环加成,得到的环加成产物在双键氢化后是可分离的,得到所需的异构体20。但由于环加成效率低下,作者放弃了这一合成路线。因此,作者将注意力转向双烯oxopyrrolium 13,酰亚胺18在TfOH条件下,经傅克环化反应产生了关键的三环中间体19。19在AlCl3条件下和二烯14经Diels-Alder环加成反应,得到了四环化合物22,含两个新的相邻季碳中心。22包含了几乎所有arcutinine中的碳原子,并且可以实现克级规模制备。

图4. 化合物12的合成。图片来源:J. Am. Chem. Soc.
22经Rh/Al2O3和H2还原环己烯双键,再用BF3•OEt2和Et3SiH对半缩醛胺进行还原,得到酰胺23。然后用LiAlH4将酰胺基还原成相应的胺。同时,还原过程中还得到了二级醇,该醇羟基随后被重新乙酰化,得到了胺12。
使用TMSI对12进行高度选择性的单脱甲基化反应,使愈创木酚24能够进行氧化去芳构化,从而得到二烯,该二烯可用来合成[2.2.2]双环。在加入原位生成的丙烯酸铅(IV)后,化合物24进行了非对映选择性的Wessely型氧化,生成了一种掩蔽的二酮中间体(25),并附加了丙烯酸酯亲二烯体。加热后,经分子内[4+2]环加成反应得到了[2.2.2]双环11,作者继续构建最后的C-C键来完成arcutinidine骨架。在秦勇教授合成atropurpuran的启发下,作者试图利用一种还原性的C-C键形成反应,即频哪醇偶联的方法。内酯11在甲醇中溶解后,得到了[2.2.2]双环的双酮和双环桥上内酯的开环产物。在同一锅中,加入SmI2使一个羰基还原去除,另一个还原为C9羟基。在此阶段,乙酸酯在微波条件下溶剂解,随后DMP氧化得到二酮26。SmI2偶联得到了所需的六环二醇(27),它具有完整的arcutinidine骨架,27的结构由X-射线晶体分析予以确证。
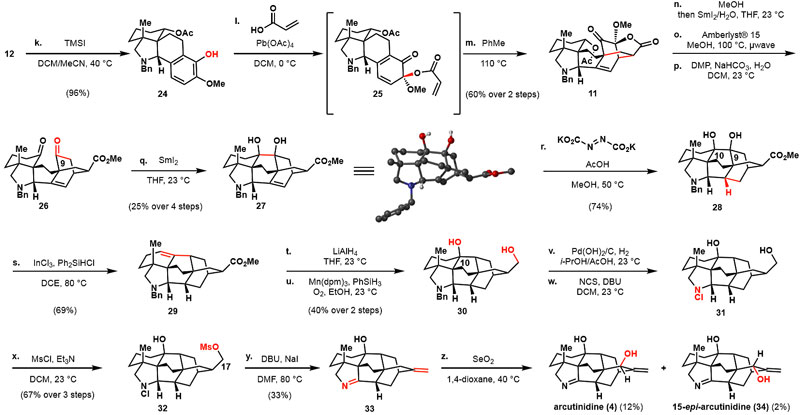
图5. arcutinidine(4)的全合成。图片来源:J. Am. Chem. Soc.
[2.2.2]双环27中的高张力双键还原得到饱和的arcutinidine母核(28)。用InCl3和Ph2SiHCl对邻二醇28进行处理后,C10羟基消除,随后另一烯丙位-C9羟基脱氧得到烯烃29。LiAlH4还原甲酯,然后Mukaiyama水合,在C10重新安装叔羟基,得到二醇30。30中苄基在Pearlman催化剂的乙酸中氢解,再经N-氯化得到31。一级醇甲磺酰基化生成32,在DBU和NaI条件下加热32,得到具有环外烯烃的亚胺33。该亚胺通过SeO2烯丙位氧化,得到arcutinidine(4)及其C15 差向异构体(34)。
总结
Richmond Sarpong课题组报道了acrutane型二萜生物碱的全合成。其合成方法受到化学网络结构分析的启发,通过环加成反应使目标化合物的三维结构快速简化。本文报道的合成对相关同源物acrutane(5)、arcutinine(6)以及atropurpuran(10)的全合成都具有重要指导意义。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Total Synthesis of the Diterpenoid Alkaloid Arcutinidine Using a Strategy Inspired by Chemical Network Analysis
Kyle R Owens, Shelby McCowen, Katherine A Blackford, Sohei Ueno, Yasuo Hirooka, Manuel Weber, Richmond Sarpong
J. Am. Chem. Soc., 2019, DOI: 10.1021/jacs.9b05815
导师介绍
Richmond Sarpong
https://www.x-mol.com/university/faculty/32
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号