基于金立方包立方的智能诊疗纳米平台用于肿瘤多模态成像和光热、光动力和化疗联合治疗
众所周知,由于肿瘤内部的血管系统分布不规则或发育不良甚至畸形,造成肿瘤的乏氧微环境。乏氧微环境是限制光动力疗效的最大屏障,大大降低了肿瘤生物治疗的疗效。同时,肿瘤乏氧微环境可导致肿瘤细胞产生多药耐药性,进一步严重影响化疗疗效。目前已有的多模态纳米诊疗平台多采取将所有元素简单整合的“一体化”策略,但构成复杂、合成困难、稳定性差和潜在的安全等问题极大地限制了这些纳米平台更为广泛的生物医学应用。
为了解决这些问题,徐州医科大学药学院高丰雷副教授团队在ACS Nano报道了一种基于金立方包立方的智能纳米平台(RGD-CCmMC NPs,其中核为Au cube-in-cube),将其用于增强多模态成像指导下的肿瘤的光热、光动力和化疗的联合治疗。有趣的是,该平台中锰掺杂的碳点(Mn-Cdot)能够在乏氧微环境中迅速产生氧气,从而有效克服乏氧环境、提高氧气水平和大大促进活性氧(ROS)的产生。金立方包立方的核心结构具有优异的光热性能和光热转换性能(65.6%),实现对实体瘤的光热消融。除此之外,还具有温度/pH双响应药物靶向运输功能。该RGD-CCmMC平台通过温度和pH敏感性的碳点“开关”实现抗癌药物在特定肿瘤位点的精确释放,最大程度放大了抗癌药物的生物疗效。
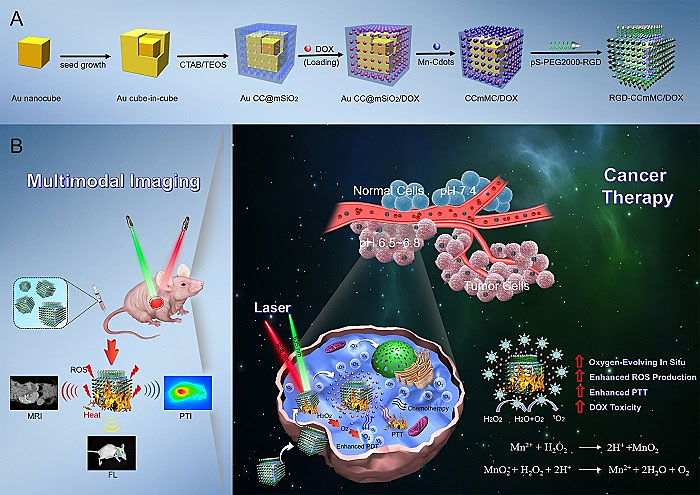
图1. 智能RGD-CCmMC纳米平台的合成过程和治疗机制的示意图
本研究设计智能纳米平台有效实现了“一体化”的治疗策略,有效结合了三种治疗成分,即金立方包立方的核心、掺杂锰的碳点以及抗癌药阿霉素。同时,纳米平台具有良好的单分散性,稳定地分散于水相体系中,掺杂锰的碳点有效封堵介孔硅的孔道,通过静电吸附方法吸附于介孔硅上,以防阿霉素在血液循环过程的损耗。此纳米平台具有良好的吸光度,是形成高效光热效应的前提,介孔硅巨大的比表面积实现了阿霉素的有效负载。这是金立方包立方合成后,该研究团队首次将其应用于肿瘤的生物治疗。
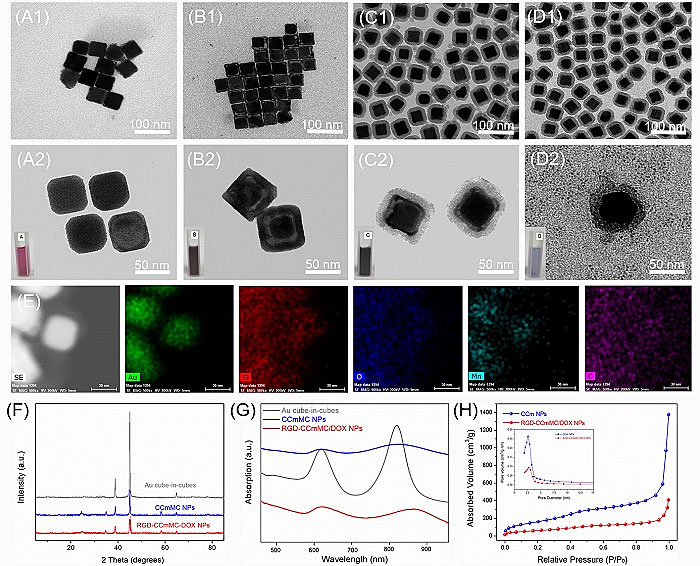
图2. 智能纳米平台的制备和表征
该研究进一步阐明,此纳米平台在体外过氧化氢水溶液条件下,表现出很强的催化能力和高效率,可有效分解过氧化氢和持续地产生氧气。同时,在细胞内,通过氧探针进一步证实了胞内氧气的产生和存在。乏氧的微环境改善后,在适宜波长的激光照射下,进一步确认了活性氧的大量产生,相比于无过氧化氢组,添加了少量过氧化氢的胞内绿色荧光更强,即ROS产生更多。

图3. 智能纳米颗粒体外产氧和过氧化氢的分解过程的检测和胞内活性氧产生的检测
RGD修饰的CCmMC智能纳米颗粒表现出高生理稳定性和生物相容性。同时此纳米平台支持PTI/FL/MRI三模态成像,提供了肿瘤的解剖学、病理学和分子学等互补信息,在准确诊断、指导治疗干预、检测肿瘤反应和治疗效果有着良好的应用前景。这项工作为肿瘤的靶向治疗提供了良好的临床新思路,为多功能纳米颗粒的开发以及医学诊疗领域的应用开辟了新的途径。
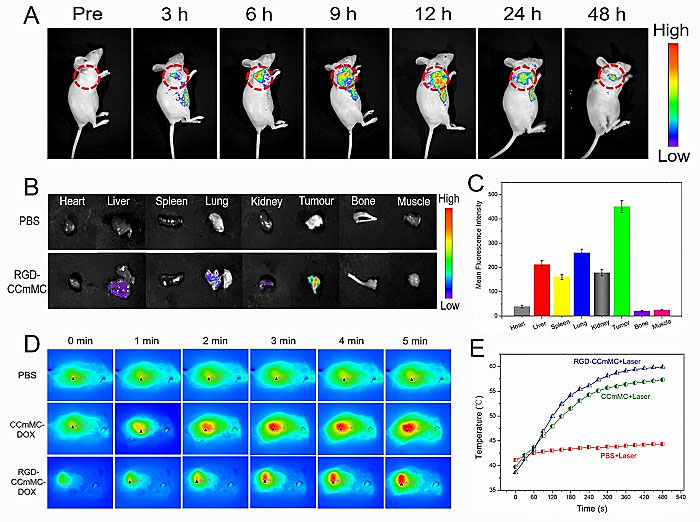
图4 智能纳米颗粒动物实验
这一研究成果近期已发表在ACS Nano上,徐州医科大学2016级硕士研究生张星为论文第一作者,郭开今教授为该论文的共同通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Gold Cube-in-Cube Based Oxygen Nanogenerator: A Theranostic Nanoplatform for Modulating Tumor Microenvironment for Precise Chemo-Phototherapy and Multimodal Imaging
ACS Nano, 2019, 13, 5306-5325, DOI: 10.1021/acsnano.8b09786
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号