刘海坤组发现GPD1或是胶质母细胞瘤干细胞的有效靶点
本文获“BioArt”授权转载,版权归“BioArt”所有,任何转载需获得“BioArt”授权。
癌症干细胞的概念源于加拿大干细胞学家John Dick实验室1994年发表的一篇论文【1】。该概念借鉴了正常组织发育过程中干细胞自我更新及分化成功能细胞的行为,后来在很多肿瘤里都发现了行为类似于“干细胞”的癌症细胞。这在一定程度上解释了肿瘤的异质性和肿瘤复发的现象。而传统化疗药物不能杀死癌症干细胞(实际上正常干细胞也有此特性)已经得到很多实验验证。但这个概念也遭遇了极大的挑战,特别是细胞的可塑性的概念对倾向于等级的癌症干细胞概念有很大冲击。最近的 Cell Stem Cell (2019一月专刊)和“新英格兰医学杂志”专文讨论了癌症干细胞研究的现状及其挑战【2-4】。癌症干细胞概念的核心价值在于靶向癌症干细胞治疗从而实现肿瘤有效控制,不然就是一个没有价值的概念。这也是目前该领域诞生25年来面临的最大挑战,截至目前还没有基于靶向癌症干细胞的有效临床抗肿瘤手段及药物。
胶质母细胞瘤是目前最难治疗的肿瘤之一,快速发展的癌症基因组及分子诊断分型丰富了我们对肿瘤的了解,但目前没有基于这些进展而发展出临床干预手段和有效药物。包括近期的免疫治疗也没有改变胶质母细胞瘤的临床现状。脑瘤干细胞由另一位加拿大科学家Peter Dirks实验室于2003年报道【5】。德国癌症研究中心刘海坤实验室曾经于2014年报道在小鼠自发胶质瘤模型中利用特异性基因打靶的方式可抑制癌症干细胞的干性,显著延长小鼠寿命【6】。该试验严谨地证明了靶向癌症干细胞是可行的治疗手段,该论文还被评为14年Cell Stem Cell最佳论文之一。
过去几年,刘海坤实验室研究重点之一转向发现癌症干细胞的新药物靶点。2019年7月11日,该课题组继续在Cell Stem Cell上发表文章GPD1 Specifically Marks Dormant Glioma Stem Cells with a Distinct Metabolic Profile,揭示了在胶质母细胞瘤干细胞中,GPD1的特异性表达改变了其代谢特征,可作为癌症干细胞的有效靶点。

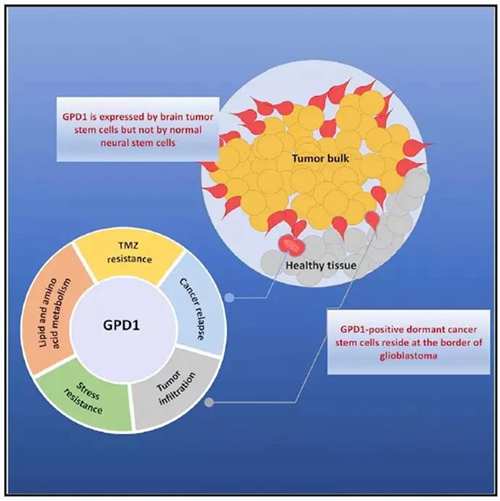
通过Ribosome Profiling 技术比较癌症干细胞和神经干细胞正在翻译的RNA之不同,研究人员发现了一批只在脑瘤干细胞而不在正常神经干细胞表达的蛋白。而甘油三磷酸脱氢酶GPD1蛋白因其几个有趣的特征,吸引了研究人员的注意力:1)作为一个酶,是天然药物靶点;2)表达特异,正常大脑几乎不表达这个基因;3)基因敲除以后正常小鼠没有异常,代表靶向这个蛋白没有副作用;4)在哺乳动物细胞里几乎没有什么功能性研究。
之后,研究人员发现GPD1在体内只存在于处于休眠状态的癌症干细胞里(Dormant cancer stem cell),这部分细胞大部分分布于脑瘤的边缘浸润区,而这群细胞在小鼠化疗以后被激活。最重要的是,如果在小鼠自发肿瘤模型内肿瘤特异性敲降GPD1, 荷瘤小鼠存活变长。证明GPD1是癌症干细胞有效靶点。据此,研究人员和著名的药物公司合作开发GPD1抑制剂,目前进展非常顺利。
因为GPD1是调控糖酵解及甘油代谢途径的关键酶,这说明休眠癌症干细胞在有效利用这个代谢途径。在酵母里GPD1是一个细胞应激蛋白,其表达对于渗透压变化及其他压力变化敏感。研究人员做了一系列的代谢组学分析证明癌症干细胞和神经干细胞的确有很大不同,而这里很多的不同依赖于GPD1的表达,这些迹象显示癌症干细胞在代谢上有非常特异的机制,这可能代表了是今后癌症靶向治疗一个新的方向。有趣的是,甘油代谢途径在动物冬眠和昆虫滞育的代谢调节都有重要的作用,这也显示癌症干细胞激活了一些特异的细胞应激存活的机制来抵御环境压力,可能进入了一种类似“冬眠”的状态,这也为今后的研究提供了有趣而意外的新方向。而GPD1抑制剂可能成为临床验证“癌症干细胞”这个概念的潜在药物。
原文链接:
https://doi.org/10.1016/j.stem.2019.06.004
参考文献
1. Lapidot, T., Sirard, C., Vormoor, J., Murdoch, B., Hoang, T., Caceres-Cortes, J., Minden, M., Paterson, B., Caligiuri, M.A., and Dick, J.E. (1994). A cell initiating human acute myeloid leukaemia after transplantation into SCID mice.Nature367, 645-648.
2. Clarke, M.F. (2019). Clinical and Therapeutic Implications of Cancer Stem Cells.N Engl J Med380, 2237-2245.
3. Prager, B.C., Xie, Q., Bao, S., and Rich, J.N. (2019). Cancer Stem Cells: The Architects of the Tumor Ecosystem.Cell Stem Cell24, 41-53.
4. Saygin, C., Matei, D., Majeti, R., Reizes, O., and Lathia, J.D. (2019). Targeting Cancer Stemness in the Clinic: From Hype to Hope.Cell Stem Cell24, 25-40.
5. Singh, S.K., Clarke, I.D., Terasaki, M., Bonn, V.E., Hawkins, C., Squire, J., and Dirks, P.B. (2003). Identification of a cancer stem cell in human brain tumors.Cancer research63, 5821-5828.
6. Zhu, Z., Khan, M.A., Weiler, M., Blaes, J., Jestaedt, L., Geibert, M., Zou, P., Gronych, J., Bernhardt, O., Korshunov, A., et al. (2014). Targeting self-renewal in high-hrade brain tumors leads to loss of brain tumor stem cells and prolonged survival.Cell stem cell15, 185-198.

如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号