Science:光照加持,烯还原酶“客串”催化不对称自由基环化
与有机合成中传统的金属催化剂相比,酶作为生物催化剂能够在室温下水环境中工作,可以容易地控制产物分子的手性,高选择性地生成产物,表现出巨大的应用潜力。然而,酶促反应往往对反应环境和底物种类都有一定要求,直接应用于有机合成往往容易失活,而且适用反应范围有限。开发具有新催化功能的酶一直是生物催化领域的挑战,为了提高酶催化有机反应的应用范围,研究者近年来多通过人工修饰(例如:血红素换个“心”,催化大不同)或者“定向进化”的方法来赋予酶更多的催化功能,后者更是获得了2018年的诺贝尔化学奖(诺奖弟子跟你聊聊“定向进化”那些事)。
光激发在有机合成中广泛用于促进自由基反应,但在酶催化中较少见。能直接使用光子能量来驱动生物反应的酶非常有限,已经报道的比如原叶绿素酸酯还原酶、脂肪酸光脱羧酶(Science, 2017, 357, 903,点击阅读详细)和DNA光裂合酶。美国普林斯顿大学的Todd K. Hyster教授课题组前几年曾发现烟酰胺依赖性酮还原酶和双键还原酶可以利用光诱导电子转移来实现不对称自由基加氢脱卤和加氢脱乙酰氧基化反应(Nature, 2016, 540, 414; Nat. Chem., 2018, 10, 770)。这些例子表明,光照射普通的氧化还原酶有可能触发非天然的催化反应,Hyster教授课题组认为这一策略可用于解决化学合成中的挑战性问题。

图1. Todd K. Hyster教授课题组。图片来源:Hyster Lab [1]
觉得合影里人太多,找不到Hyster教授?没关系,Hyster课题组也贴心的想到了这一点,下面这张图让你会瞬间记住Hyster教授的容颜……还能顺便玩个猜一猜连连看……

图2. Todd K. Hyster教授“课题组”。图片来源:Hyster Lab [1]
PS恶搞照片堂而皇之的放在课题组网站上,看来Hyster教授是个心相当大的PI,实验室里估计也是欢乐多多。
言归正传。最近,Hyster教授课题组又有突破。他们发现黄素依赖烯还原酶(flavin-dependent ene-reductases)在蓝绿光照射条件下,黄素会被激发并改变烯还原酶的催化功能,能够催化自然条件不能催化的不对称自由基环化反应,由含烯基的α-氯酰胺选择性合成五、六、七和八元环内酰胺。这在医药和农药等合成过程中具有重要的价值。相关工作发表在Science 杂志上。

图3. 光辅助生物催化选择性自由基环化反应的策略。图片来源:Science
亲电自由基对非活化烯烃的不对称加成反应在医药、农药和材料等合成领域具有重要的意义。但是在实现反应的选择性方面还有很多挑战,这主要是因为需要保持自由基和手性催化剂之间的联系,还缺乏向前手性自由基提供氢原子的试剂(图3A)。基于以上问题,作者认为酶是该反应的理想催化剂,因为它们能够精准控制反应物的构象(图3B)。作者以α-氯酰胺制备手性β-内酰胺反应为模型,来寻找合适的酶作为生物催化剂。他们把目光投向了黄素依赖烯还原酶,它的活性位点较大,能够还原碳碳双键,且反应选择性高、产率好、条件温和,能用于作为环境友好的合成策略。在烯还原酶(ERED)的催化过程中需要黄素辅因子的参与,该辅因子是氢的载体,能够用于还原代谢物。Hyster教授课题组测试了筛选得到氧化葡萄糖酸杆菌(Gluconobacter oxydans)烯还原酶(GluER),在近紫外光(390 nm)照射下能够有效促进α-氯酰胺1不对称环化得到γ-内酰胺2,得到中等的收率和对映选择性控制。对光源进行优化之后,他们发现蓝绿光(497 nm)照射下,产率和对映选择性都有提高,同时产生少于2%的加氢脱卤产物(图3C,entry 1)。为进一步提高GluER对该非自然反应的催化活性,作者将位于酶蛋白表面的残基T36突变为丙氨酸(GluER-T36A),进一步提高了产率,并且只有痕量的氢化脱卤产物(图3C,entry 3)。作者解析了GluER和GluER-T36A的单晶结构,不过并没有发现能够解释T36A突变提高产率的结构差异。这一突变对酶原本的功能没有损害,能降低催化剂的用量而不影响产率和对映选择性控制。甚至,该反应可以使用冻干的无细胞裂解物进行,这使得反应可以在克级规模实现,而且产率和对映选择性控制都不受太大影响(图3C,entry 4)。在8小时内缓慢加入葡萄糖,反应可以在空气中进行,产率和对映选择性与在惰性气氛下进行的反应相当(图1D)。
随后作者利用该方法合成一些重要的内酰胺类衍生物(图4),结果证明该反应具有优异的官能团兼容性,可用于修饰多种官能团的底物。当产物中有芳香基时,无论苯环上的取代基在邻、间或者对位上对产物产率和选择性影响都不大(8-12)。除此之外,底物中取代基的亲电性对反应效率影响也很小(17-20)。为了进一步证明该方法的普遍性,作者又考察了不同来源的ERED(比如念珠藻、干酪乳杆菌等),同样都能催化该不对称自由基反应。作者使用不同的酶还获得了不同的立体化学选择性,α-氯酰胺被分别转化为五元、六元、七元或八元内酰胺(22、24、26、28),这可能是因为不同的酶具有不同的活性位点口袋结构。此外,GluER-T36A在非对映选择性环化反应(30、32、34)中也有不错表现。这些结果进一步证明了该策略的潜在价值。
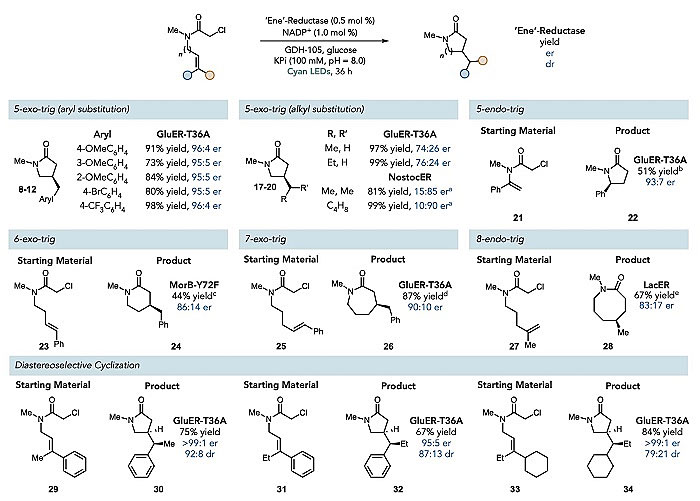
图4. 生物催化自由基环化反应的应用范围。图片来源:Science
作者进一步研究了反应的机理(图5)。他们发现利用蓝绿光照射黄素能使其处于激发状态,然后其与α-氯酰胺反应生成碳自由基,该自由基能与碳碳双键反应生成环状化合物和另外一个自由基,这一自由基可从黄素上攫氢形成内酰胺。酶产物解离,同时还原型黄素辅因子通过NADPH再生,从而完成催化循环(图6)。在该反应起始阶段,α-氯酰胺和还原型黄素辅因子能在酶的活性位点上形成电子给受体复合物,电子给受体复合物的光激发直接促进了从黄素辅因子到底物的电子传递。
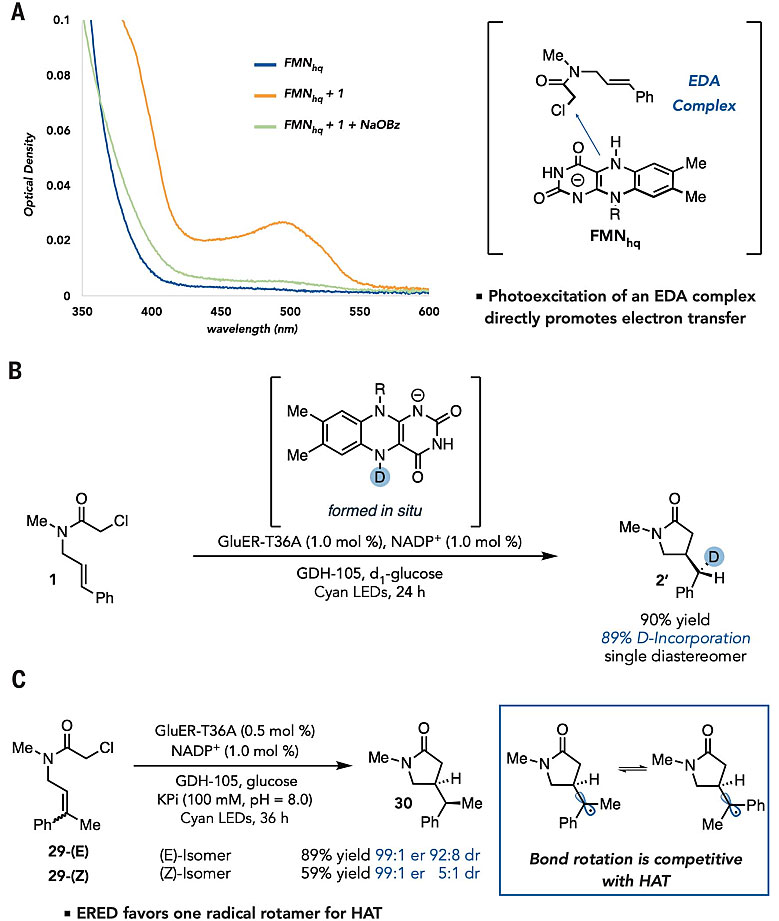
图5. 研究反应机理的实验。图片来源:Science
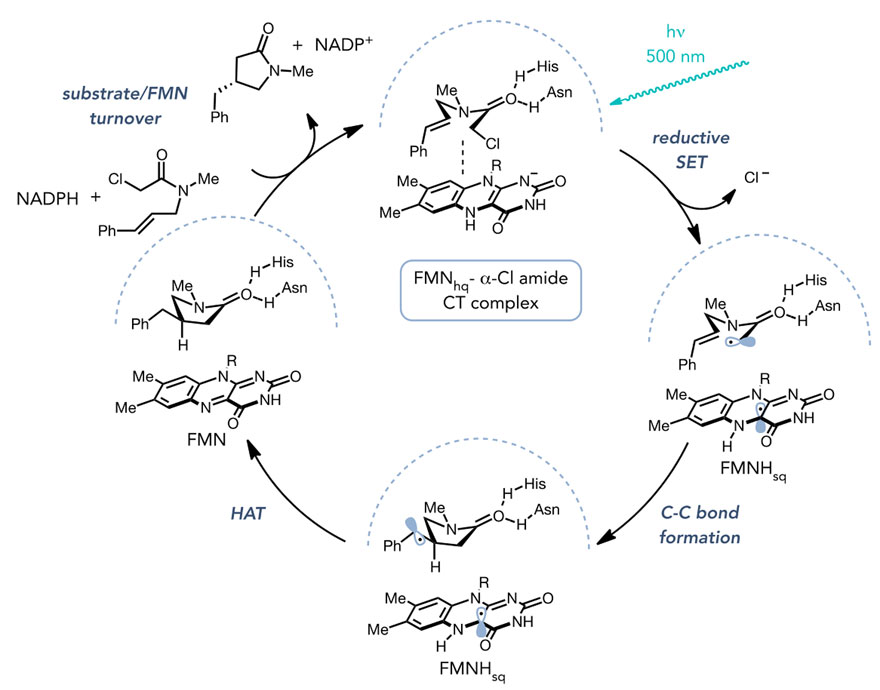
图6. 酶催化自由基亲电环化反应的机理循环。图片来源:Science
总结
Todd Hyster教授课题组研究了在光照条件下黄素依赖烯还原酶在有机合成反应中的应用,通过光激发黄素辅因子,让黄素依赖烯还原酶实现了自然界中无法进行的立体选择性自由基环化反应。而且该反应在空气中即可进行,具有优异的官能团兼容性,合成能达到克量级。该工作证明了包括烯还原酶在内的氧化还原酶在光照下促进不对称自由基反应的可能性和普遍性,这为以后开发新的酶促反应以合成重要的有机分子提供了理论基础。
C&EN 在报道这项工作的时候,还提到了一个趣事,原来具有更好活性的突变体GluER-T36A其实是个“美丽的错误”。接受采访时,Hyster教授弱弱地说道,“当我们订购用于制造酶的基因时,我们实际上敲错了字母。老实说,这完全是我的错。” [2]
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Photoexcitation of flavoenzymes enables a stereoselective radical cyclization
Kyle F. Biegasiewicz, Simon J. Cooper, Xin Gao, Daniel G. Oblinsky, Ji Hye Kim, Samuel E. Garfinkle, Leo A. Joyce, Braddock A. Sandoval, Gregory D. Scholes, Todd K. Hyster
Science, 2019, 364, 1166-1169, DOI: 10.1126/science.aaw1143
参考内容:
1. Hyster Lab
2. Light gives enzyme a radical new role
https://cen.acs.org/synthesis/biocatalysis/Light-gives-enzyme-radical-new/97/i25
撰稿:Sunshine
审校:龙须友
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号