银催化的2,2,2-三氟重氮乙烷与甘氨酸酯亚胺的[3+3]偶极环加成反应:一种构建三氟甲基取代的三氮嗪和吡啶的有效策略
三氟甲基取代的含氮杂环骨架广泛存在于多种药物、农药及相关生物活性分子中,因此如何高效构建该类化合物一直是有机及药物合成领域的重点。其中,分子间的偶极环加成反应以其原子经济性受到广泛关注。天津大学马军安(点击查看介绍)团队一直致力于2,2,2-三氟重氮乙烷的反应性研究,并相继报道了其与炔烃(Angew. Chem. Int. Ed., 2013, 52, 6375-6378)、苯炔(J. Fluorine Chem., 2015, 174, 88-94)、烯烃(Org. Lett., 2017, 19, 3406-3409; Synlett, 2017, 28, 673-678; Angew. Chem. Int. Ed., 2017, 56, 4569-4574)、联烯(Org. Lett., 2014, 16, 3122-3125)、异腈(Org. Chem. Front., 2015, 2, 1468-1474)以及芳基重氮盐(Chem. Commun., 2015, 51, 16545-16548)的[3+2]偶极环加成反应,从而高效构建出一系列三氟甲基取代的吡唑、吲唑、吡唑啉、三氮唑及四氮唑类衍生物。
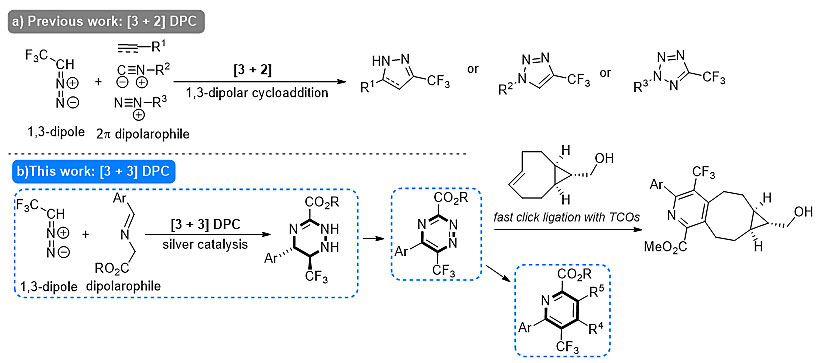
图1. 2,2,2-三氟重氮乙烷参与的偶极环加成反应
最近,该团队又发展了银催化的2,2,2-三氟重氮乙烷与甘氨酸酯亚胺的[3+3]偶极环加成反应。通过对金属催化剂、碱、溶剂及温度的考察,他们确定了溶液法及一锅法反应的最优条件(图2):(1)溶液法:甘氨酸甲酯亚胺(0.4 mmol, 1 equiv),醋酸银(10 mol%),碳酸铯(1.0 equiv),2,2,2-三氟重氮乙烷(0.2 M in THF, 4 mL),0 ℃, 24 h; (2)一锅法:甘氨酸甲酯亚胺(0.4 mmol, 1 equiv),氟化银(10 mol%),碳酸铯(1.25 equiv),2,2,2-三氟乙胺(2 equiv),亚硝酸叔丁酯(2.2 equiv),乙酸(0.4 equiv),0 ℃, 24 h。
在最优条件下,作者对底物的适用性进行了考察。总体来说,溶液法和一锅法可以获得相当或者互补的反应效果。对于苯甲醛衍生的甘氨酸酯亚胺,苯环上无论带有吸电子取代基,还是供电子取代基,均能很好地适用于该反应体系;稠环以及杂环取代甘氨酸酯亚胺如1-萘基、2-萘基、9-蒽基、2-噻吩基、以及3-吡啶基的底物也能取得不错的反应效果;特别地,作者还顺利将三(全氟叔丁基)季戊四醇(含有27个化学环境相同且相邻位置没有氢原子的氟原子)引入到底物中,从而为核磁共振成像提供了可能。

图2. 2,2,2-三氟重氮乙烷与甘氨酸酯亚胺偶极环加成反应的最优条件
为了探究反应机理,作者做了几组氘代实验(图3a-d)。当采用氘代的2,2,2-三氟重氮乙烷或者甘氨酸酯亚胺D1-1a作底物时,环加成产物四氢三氮嗪C6及C5位置的氘/氢比例与反应物一致,这表明从反应物到产物的转化过程中,这两个位置的碳-氢键并没有发生断裂。当采用氘代的甘氨酸酯亚胺D1-1a作底物时,四氢三氮嗪N1及N2位置没有检测到氘的存在。而在控制实验中,环加成产物与5当量的氘代水室温搅拌2小时后,可以发现四氢三氮嗪N1和N2位置分别有67%和69%的氘代。这表明,环加成产物与水容易发生分子间的质子交换。
基于此,作者提出了可能的反应机理(图3e)。在醋酸银和碳酸铯存在下,甘氨酸酯亚胺首先生成烯醇银中间体A,随后中间体A与2,2,2-三氟重氮乙烷发生[3+3]偶极环加成反应生成银络合物B,该过程经历了一个椅式六元环过渡态(TS),在该过渡态中,2,2,2-三氟重氮乙烷的三氟甲基以及甘氨酸酯亚胺的芳基和酯基均处于平伏键位置,以此降低位阻效应,这在一定程度上解释了为何环加成产物四氢三氮嗪的三氟甲基和芳基处于反式位置。中间体B一经生成,会快速发生1,3-氢迁移和质子化生成相对稳定的中间体C。这也在一定程度上解释了为何丙氨酸酯或者苯丙氨酸酯亚胺(相应位置的氢分别被甲基或者苯基取代)并不适用于该偶极环加成反应。最后,中间体C再一次发生1,3-氢迁移从而生成目标产物。
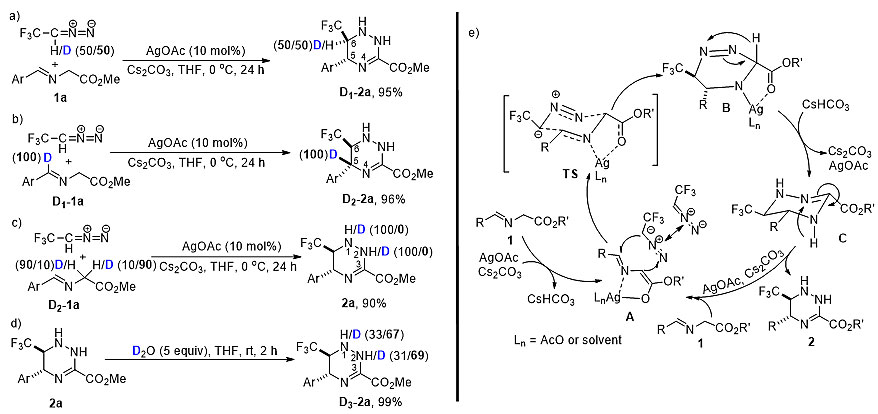
图3. 氘代实验及可能的反应机理
作者进一步探究环加成产物的合成转化。在DDQ作用下,四氢三氮嗪2可以顺利芳构化生成一系列三氟甲基取代的三氮嗪类衍生物3。而三氮嗪3又可以与多种亲双烯体如降冰片二烯、苯炔以及醛、酮衍生的烯胺发生反电子需求的Diels-Alder反应,以较高的收率生成一系列3-三氟甲基吡啶衍生物(图4)。

图4. 合成转化
最近,1,2,4-三氮嗪逐渐成为一种新型的生物正交反应试剂,但是已知的1,2,4-三氮嗪均具有较低的反应速率,从而限制了该类化合物的广泛应用。作者注意到,他们合成的6-三氟甲基-1,2,4-三氮嗪含有一个可修饰的芳基和两个吸电子取代基,这个特点极有可能使该类化合物具有较高的反应活性,从而成为一类合适的生物正交反应试剂。为了验证该可能性,作者首先对已知的三种1,2,4-三氮嗪T1-T3以及他们合成的1,2,4-三氮嗪3f和反式环辛烯(TCO)的反应性进行理论计算。如图5所示,1,2,4-三氮嗪3f具有最低的LUMO轨道能量,这表明3f可能具有更高的反应速率常数。
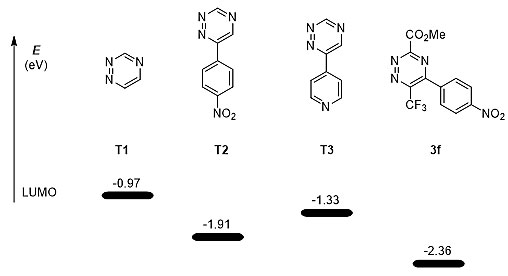
图5. 几种1,2,4-三氮嗪的LUMO轨道能量
随后,作者利用19F-核磁共振以及UV检测器对多种6-三氟甲基-1,2,4-三氮嗪3和TCO以及s-TCO的反应性进行研究。如图6所示,当与TCO反应时,苯环上含有吸电子取代基的底物具有较高的速率常数,而苯环上含有供电子取代基的底物则具有较低的速率常数。当采用s-TCO作底物时,这些1,2,4-三氮嗪的速率常数可以获得显著提高。特别地,底物3f的二级反应速率常数可以达到99.24 M−1 s−1,这也是目前1,2,4-三氮嗪目前达到的最高的反应速率。
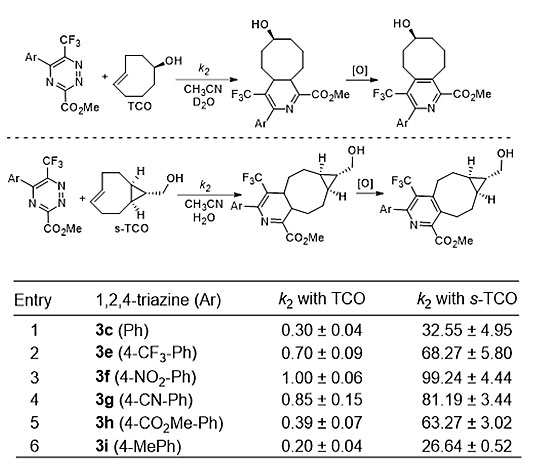
图6. 6-三氟甲基-1,2,4-三氮嗪3与环张力烯烃的二级反应速率常数
这一成果近期发表于ACS Catalysis 上。共同第一作者为博士生陈振和任楠,共同通讯作者为张发光副教授和马军安教授。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Silver-Catalyzed [3+3] Dipolar Cycloaddition of Trifluorodiazoethane and Glycine Imines: Access to Highly Functionalized Trifluoromethyl-Substituted Triazines and Pyridines
Zhen Chen, Nan Ren, Xiaoxiao Ma, Jing Nie, Fa-Guang Zhang, Jun-An Ma
ACS Catal., 2019, 9, 4600-4608, DOI: 10.1021/acscatal.9b00846
导师介绍
马军安
https://www.x-mol.com/university/faculty/13330
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
锰催化“一锅”构筑氮杂三环嗪 2018-09-24
-
无痕活化及导向基策略构建4-取代-3-三氟甲基吡唑 2017-07-18


































 京公网安备 11010802027423号
京公网安备 11010802027423号